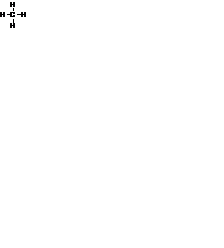ОРГАНИЧЕСКАЯ ХИМИЯ 4 страницаКлассификация органических соединений
Существование гомологии и гомологических рядов существенно облегчает классификацию и изучение органических соединений. Гомологическим рядом называется ряд веществ, отличающихся друг от друга на любое число групп СН2, имеющих сходное строение и свойства. В зависимости от строения углеродной цепи органические соединения делятся на соединения с открытой цепью (это алифатический, или жирный ряд) и циклические соединения. Циклические соединения могут быть карбоциклическими (циклы составлены только из атомов углерода) и гетероциклическими (циклы содержат кроме углерода и другие атомы). В свою очередь, карбоциклические соединения включают алициклический и ароматический ряды. Наиболее простыми соединениями алифатического, алициклического и ароматических рядов являются углеводороды. Заменяя атомы водорода на другие атомы или группы (так называемые функциональные группы), мы получаем другие классы органических соединений, свойства которых, в основном, определяет природа функциональных групп. В зависимости от наличия в соединении функциональной группы определенной природы можно выделить следующие главнейшие классы органических соединений: – углеводороды; – галогенпроизводные; – гидроксисоединения; – простые эфиры; – карбонильные соединения (альдегиды и кетоны); – карбоновые кислоты; – амины; – нитросоединения; – сульфокислоты; – элементорганические соединения. Существует еще много классов соединений с другими функциональными группами. Кроме того, вещества могут быть насыщенными и ненасыщенными, содержать одну какую-либо функциональную группу или одновременно несколько одинаковых или различных.
Основные сырьевые источники органических соединений
Природный газ В природном газе находятся низшие газообразные алканы – метан, этан, пропан. Содержание метана в смеси обычно доходит до 98 %. Перерабатывается преимущественно пиролизом (высокая температура) на ацетилен, водород, газовую сажу. Нефть Нефть – наиболее важный источник углеводородного сырья. Она представляет собой темно-коричневую вязкую маслянистую жидкость с удельной массой около 0, 8 г·см-3. Среднее содержание в нефти углерода составляет 82 %…88 %, водорода – 12 %…14 %. Таким образом, нефть на 94 %…99 % состоит из смеси углеводородов. Кроме того, в небольших количествах в неё входят кислород-, серу- и азотсодержащие соединения. Ненасыщенных соединений алифатического и алициклического рядов нет. Углеводороды представлены соединениями трех классов: алканы (метановые углеводороды), цикланы (нафтены) и ароматические углеводороды. Метановые углеводороды содержатся в нефти в основном в виде н -алканов. Среди изомеров преобладают малоразветвленные. Так, метилалканов больше, чем ди- и триметилалканов. Цикланы представлены почти исключительно пяти- и шестичленными циклами, ароматические углеводороды – производными бензола. В несколько меньших количествах в нефти встречаются соединения с конденсированными кольцами циклического, ароматического и циклоароматического характера. В нефти имеются газообразные, жидкие и твердые углеводороды. После поднятия нефти на поверхность земли от неё отделяют газообразные соединения (попутный газ), воду, механические примеси и подвергают разгонке на фракции по температурам кипения. При этом выделяют фракции авиационного и автомобильного бензинов, лигроина, керосина, солярового масла и мазута. Лигроин, керосин, соляровое масло используют в качестве горючего в дизельных двигателях. Керосин после дополнительного гидрирования служит топливом для реактивных двигателей. Мазут разгоняют под вакуумом с выделением фракций легких и тяжелых масел, которые в больших количествах используются в промышленности и транспорте. Остаток после перегонки (пёк) используется как дорожное покрытие. В двигателях всех типов происходит сгорание углеводородов преимущественно до СО2 и Н2О. На промежуточной стадии окисления образуются гидроперекиси ROOH, которые распадаются на альдегиды, кетоны, спирты, кислоты и недолгоживущие свободные радикалы. В двигателе внутреннего сгорания при сжатии смеси паров бензина и воздуха н -алканы могут образовывать перекиси, вызывающие преждевременное воспламенение без участия запальной свечи, которая даёт искру только в момент наибольшего сжатия смеси. Явление это называется детонацией. Оно причиняет вред, т.к. двигатель быстрее изнашивается и мощность его используется неполностью. Разветвленные алканы, цикланы и особенно ароматические углеводороды в меньшей мере склонны к детонации. Детонационная стойкость бензинов оценивается октановыми числами. Октановое число изооктана С целью увеличения выхода бензина, улучшения его качества и получения сырья для нефтехимической промышленности высококипящие фракции нефти (начиная с керосина) подвергают так называемой деструктивной переработке. К процессам деструктивной переработки относятся термический и каталитический крекинги, пиролиз и риформинг. В этих процессах большие молекулы углеводородов претерпевают разрыв по С–С связи с образованием соединений с более короткой цепью углеродных атомов, соответствующих бензину. Именно эта реакция разрыва цепи характерна для термического крекинга, протекающего по радикальному механизму при температурах 400 °C…600 °С и давлении 20…40 атм с образованием алканов и алкенов. R-CH2-CH2╫ CH2-CH2-CH2-CH2-CH2-CH2-CH3 ® ® R-CH2-CH3 + CH2=CH-CH2-CH2-CH2-CH2-CH3 В результате термического крекинга получается большое количество алканов и алкенов с более короткой цепочкой. Выход бензина, считая на сырую нефть, увеличивается при этом с ~ 30 % до ~ 50 %…60 %. Однако присутствие ненасыщенных соединений (алкенов) ухудшает качество бензина. Температура пиролиза выше: 700 °C…900 °С. В этих условиях получается много ненасыщенных газообразных углеводородов с малой молекулярной массой, которые служат сырьем для нефтехимии. Каталитический крекинг протекает при температуре Качество бензина прямой гонки может быть улучшено путем каталитического риформинга. (Условия: t ~ 500°С; давление 15…40 атм; катализатор: платина на Al2O3). В этом процессе алициклические углеводороды и некоторые алканы превращаются в ароматические углеводороды, которые имеют высокие октановые числа. Каменноугольная смола Каменноугольная смола наряду с коксом, коксовыми газами и надсмольной водой получается при коксовании каменного угля. Содержит широкий спектр ароматических и гетероциклических соединений.
1 УГЛЕВОДОРОДЫ
1.1 Алканы
Алканы (парафины или предельные углеводороды) – наиболее простой по элементному составу класс органических соединений. Они состоят из углерода и водорода. Родоначальником этого класса является метан СН4. Все остальные углеводороды, относящиеся к алканам, являются членами гомологического ряда метана. Общая формула алканов СnН2n+2
Углерод имеет на внешней оболочке четыре валентных электрона, поэтому он может образовывать с атомами водорода четыре двухэлектронные ковалентные связи:
Атом углерода образовывает ковалентные связи за счёт одного s -электрона и трех р -электронов, а атом водорода – за счёт единственного s -электрона. Судя по числу s - и р -электронов, должны быть три s-р связи и одна s-s. Однако физические и химические данные указывают на равноценность всех четырех связей С–Н в метане. Действительно, в метане s - и р -орбитали образуют четыре одинаковые смешанные или гибридные орбитали. Подобный тип гибридизации назвают sр3 -гибри-дизацией. Углы между связями 109о28' – тетраэдрические. Связь С–Н в метане может разрываться тремя различными способами: 1) электронная пара остается у атома углерода, углерод приобретает отрицательный заряд и образуется анион: Н3С: – – карбанион; 2) электронная пара переходит к водороду, углерод заряжается положительно и возникает катион: Н3С+ – карбкатион; 3) связь разрывается так, что один электрон остается у углерода, а другой – у водорода. Это приводит к появлению двух незаряженных частиц, несущих по одному неспаренному электрону: метильному радикалу Н3С• (Н3С-) и радикалу (атому) водорода Н• (Н-). Такие частицы называются свободными радикалами. В общем случае при разрыве одной связи С–Н в алканах образуется один, а при разрыве связи С–С – два одновалентных углеводородных радикала, которые называются алкилами. Ниже приводятся названия некоторых одновалентных насыщенных радикалов нормального строения:
От метана также можно произвести двухвалентный радикал метилен Н2С< и трехвалентный НС≡ – метин. Таким образом, этан может образоваться из двух метильных радикалов в результате образования между углеродами связи за счет объединения их неспаренных электронов:
Заменяя водород в этане на метильный радикал СН3•, получаем пропан. Образовывая таким же образом следующий алкан – бутан – можно заметить, что если на метильную группу заменить водород у крайнего углерода – получим бутан с неразветвленной, или нормальной цепью атомов углерода или, как говорят, с «нормальным скелетом». Если заменяется водород метиленовой группы пропана, –СН2–, то цепь разветвится и получится углеводород того же состава, изобутан, изомерный н -бутану и отличающийся от него по своим свойствам:
Пентан имеет уже три изомера:
При переходе к высшим гомологам число изомеров резко возрастает (смотри выше). Углеродный атом, связанный с одним соседним углеродным атомом, называется первичным, с двумя – вторичным, с тремя – третичным и с четырьмя – четвертичным:
Органическая химия с миллионами соединений требует точной и ясной номенклатуры (системы названий), так чтобы по названию соединения можно было написать его структурную формулу и наоборот. Для названий алканов может использоваться несколько номенклатур: – историческая, или тривиальная номенклатура – это сводка исторически устоявшихся названий часто употребимых органических соединений. Поскольку углеродные структуры алканов лежат в основе соединений остальных классов органических соединений, их названия следует запомнить. Тривиальные названия наиболее простых нормальных алканов приведены в начале раздела; – рациональная номенклатура. При составлении названия по этой номенклатуре соединение рассматривается как полученное из самого простого представителя ряда в результате замещения в нем водородных атомов на алкильные радикалы. Вначале называются радикалы, начиная с меньших, а затем основа. Основа выбирается из условия получения радикалов наименьшего размера:
– номенклатура IUPAC (ИЮПАК – Международный союз теоретической и прикладной химии). Первые правила приняты в 1892 г., последняя их редакция проведена в 1979 г. Для наименования разветвленных углеводородов нужно выбрать наиболее длинную углеродную цепь, назвав нормальный углеводород. Ответвления рассматриваются как замещающие радикалы, и их названия ставятся перед названием нормального углеводорода-основы по алфавиту. Положение замещающих радикалов в главной цепи обозначают, пронумеровав её углеродные атомы, начиная с конца, более близкого к разветвлению, и указывая номера углеродов основной цепи, с которыми эти радикалы связаны, перед их названием. Номера проставляются для каждого заместителя без исключения. Названия одинаковых алкильных заместителей объединяются с использова-нием умножающих приставок (диэтил-, триметил- …). Следует также помнить, что алкильные радикалы, начиная с пропильных, представлены совокупностями их изомеров, которые имеют тривиальные названия, используемые в различных номенклатурах. Следует запомнить названия и строение следующих алкильных радикалов:
Приставки «изо» и «нео» являются неотделяемыми и участвуют при расстановке названий радикалов по алфавиту, приставки
Для характеристики строения и свойств алканов важное значение имеет вопрос об их пространственном строении, о расположении атомов углерода и водорода в пространстве. Как уже говорилось, в метане атом углерода связан с четырьмя атомами водорода, которые располагаются в пространстве симметрично относительно углерода. При этом направления от атома углерода к водородным атомам идут по осям правильного тетраэдра.
Углы между связями составляют 109°28'. Если углерод удерживает разные атомы, углы между связями меняются, но несущественно. Максимальное перекрывание sp3-гибридных орбиталей происходит при тетраэдрическом расположении. Из рентгеноструктурных данных известно, что центры атомов углерода в алканах удалены друг от друга на 0.154 нм, а центры атомов углерода и водорода – на 0, 109 нм. Тетраэдрическое расположение атомов углерода и водорода свойственно и для всех остальных алканов и их производных. В этане, построенном из двух тетраэдрических атомов углерода, направление С–С связи совпадает с направлением свободных валентностей атомов углерода в радикалах. Взаимное пространственное расположение метильных групп в этане не является закрепленным. Они могут поворачиваться вокруг связи С–С как вокруг оси и образовывать различные пространственные конфигурации молекулы, называемые конформациями. Известно, что внутреннее вращение молекул не свободно, оно заторможено. Это означает, что существуют определенные предпочтительные по своей энергетической устойчивости конформации молекул, которые могут переходить друг в друга и которые находятся в равновесии между собой. Время жизни конформации порядка 10-10 с. Но при относительном взаимном вращении групп в состоянии энергетически выгодных конформаций вращение притормаживается и соединение в этих конформациях находится большее время. Поворотная изомерия характерна для соединений, которые при внутреннем вращении образуют хотя бы две устойчивые конформации различного пространственного строения, которые и называют поворотными изомерами. Судя по изменению энергии (Е), при повороте одной метильной группы этана относительно другой на 360° из-за различного дестабилизирующего взаимодействия их водородных атомов между собой он трижды образует наиболее стабильную так называемую «заторможенную», или «шахматную» конформацию (углы поворота 60°, 180° и 300°) и трижды – энергетически менее выгодную «заслоненную» конформацию (углы поворота 0°, 120° и 240°), строение которых показано на рисунке 1 с использованием формул «с пунктир-ными линиями и клиньями» и так называемых «проекций Ньюмена»
Рисунок 1 – Изменение энергии (Е) при относительном вращении одной метильной группы этана относительно другой; заслоненная Поскольку стабильная конформация одна (при повороте на 360° образуется три идентичных по строению и энергии стереоизомера), поворотных (вращательных) изомеров у этана нет. Рассмотрим поворотную изомерию н-бутана СН3-СН2 – СН2-СН3 при относительном вращении этильных групп вокруг центральной связи С–С. Изменение энергии при этом и проекции Ньюмена стереоизомеров, получаемых при вращении через каждые 60°, представлены на рисунке 2.
Рисунок 2 – Изменение энергии (Е) при относительном вращении этильных групп н-бутана вокруг центральной связи С–С; конформации, образующиеся при вращении через каждые 60° Наиболее энергетически выгодным стереоизомером бутана является «заторможенная» конформация D, в которой наиболее объемные метильные группы этильных радикалов находятся на максимально возможном удалении друг от друга и взаимодействуют слабо. Скошенные зеркально изомерные формы В и F, обладающие одинаковой энергией, несколько дестабилизированы из-за сближения метильных групп в гош -положении. Наименее стабильной является заслоненная конформация А, в которой метильные группы пространственно максимально сближены. Таким образом, н -бутан представлен двумя поворотными изомерами: преобладающей в смеси стереоизомеров заторможенной формой D и менее стабильной скошенной формой В(F). Относительное содержание их в смеси зависит, прежде всего, от температуры и оказывает влияние на физико-химические свойства углеводорода и его реакционную способность. Взаимодействие атомов водорода метильных групп в этане слабое, поэтому вращение происходит почти свободно и одна конформация переходит в другую очень легко. Тем не менее шахматная конформация этана несколько устойчивее заслоненной, поскольку атомы водорода более удалены друг от друга. Почти свободное или, по крайней мере, очень быстрое вращение возможно вокруг всех простых связей, за исключением случаев, когда вращающиеся группы настолько велики, что «зацепляются» при повороте и в случае химической связи между ними (например, в циклогексане). Именно поэтому не удается выделить форму молекул вещества, которая соответствовала бы какой-либо определенной конформации. В соответствии с тетраэдрическим расположением атомов нормальная цепь алкана должна иметь зигзагообразный вид:
И, поскольку вращение возможно вокруг любых связей С–С и оно почти свободно, углеродная цепь может иметь самые разные формы, вплоть до спиральной, свернутой:
Действительно, при нормальных условиях н -алканы представлены преимущественно набором свернутых конформаций.
Нахождение алканов в природе Алканы наряду с соединениями других классов (циклоалканами и ароматическими углеводородами) входят в состав нефти. Содержание их в нефти колеблется от 30 % до 90 %. Другим природным источником предельных углеводородов служит природный газ. В состав природного газа входят газообразные углеводороды, в основном метан (до 98 %), этан и пропан. При перегонке нефти получаются продукты, более или менее богатые алканами: петролейный эфир, бензин, керосин, соляровые масла, смазочные масла, вазелин, парафин. Твердые высокоплавкие парафины встречаются в виде залежей так называемого озокерита. Очищенный озокерит – церезин – служит заменителем воска. Парафины можно выделить из продуктов сухой перегонки бурых углей и торфа (нагревание до температуры 500 °C…600 °С без доступа кислорода).
Способы получения алканов – Гидрирование ненасыщенных углеводородов СН2=СН2 + Н2 ® СН3–СН3; СН≡ С–СН3 + 2Н2 ® СН3–СН2–СН3 Гидрирование газообразным водородом протекает в присутствии катализаторов и чаще всего под давлением. Наиболее сильными катализаторами являются металлы платиновой группы в мелко раздробленном состоянии. Часто используются катализаторы типа «никеля Ренея». – Из галоидных алкилов (реакция Вюрца, 1870 г.) Способ заключается в действии натрия на галоидные алкилы. При этом два углеводородных остатка соединяются, образуя молекулу углеводорода: 2 СН3- СН2I + 2Na ® СН3–СН2–СН2–СН3 + 2NaI Можно брать и два разных галоидных алкила. В этом случае образуется смесь трех разных алканов: СН3I + С2Н5I +2Na ® СН3–СН3 + СН3–СН2–СН2–СН3 + СН3–СН2–СН3+ 2NaI Вместо натрия используются и другие металлы (например, цинк). Реакция Вюрца имеет большое значение не только для синтеза углеводородов, но и для доказательства их строения. – Из карбоновых кислот Нагревание солей карбоновых кислот с натронной известью или едким натром приводит к образованию алканов:
– Промышленный синтез из оксида углерода (II) (синтез Фишера, Тропша). При пропускании смеси СО и Н2 при t = 200 °С и атмосферном давлении над железным или кобальтовом катализатором образуется смесь алканов – «синтин», состоящая из нормальных парафинов с разной длиной цепи и примесью разветвленных: nCO + (2n+1)H2 → СnH2n+2 + nH2n+2 – Крекинг и пиролиз алканов нефти: СnH2n+2 ® СmH2m+2 + Сn-mH2(n-m)
Физические свойства алканов Согласно теории химического строения физические свойства веществ зависят от их состава и строения. Наиболее закономерно в гомологическом ряду предельных углеводородов изменяются температуры кипения. Первые четыре члена ряда – метан, этан, пропан и бутан – при комнатных условиях газы. Алканы С5–С15 – жидкие, а С16 и далее – твердые. Начиная с н -С5, при переходе от одного гомолога н -алкана к другому температура кипения растет каждый раз на 25 °C…30 °С, причем эта «гомологическая разность» постепенно уменьшается, снижаясь у 18-го члена ряда до 14 °С.
Превращению жидкого вещества в газообразное противо-действуют слабые силы взаимного притяжения атомов разных молекул. Это притяжение тем больше, чем больше атомов в молекуле и чем сильнее могут сближаться их атомы. Первый фактор проявляется в плавном повышении температур кипения гомологов нормального строения. Закон перехода количественных изменений в качественные в данном случае имеет очень удачное приложение. Постепенное увеличение молекулярной массы на 14 (молекулярная масса группы –СН2–) от одного гомолога к другому приводит к резкому скачку в свойствах – изменению агрегатного состояния: С4 – газ, а уже С5 – жидкость. Второй фактор проявляется в различии температуры кипения изомерных углеводородов, имеющих одинаковую молекулярную массу. Нормальные углеводороды, молекулы которых лучше всего «упаковываются» в жидкой фазе, обладают наивысшими температурами кипения и наибольшей плотностью. Наиболее разветвленные – наинизшими температурами кипения и плотностями (табл.1).
Таблица 1– Температуры кипения, плавления и плотности изомеров пентана
Твердые алканы кристалличны. Температура плавления отражает прочность межмолекулярных связей в кристалле. Она также определяется молекулярной массой соединения и в большой мере зависит от геометрических факторов упаковки молекул в кристаллической решётке. Чем симметричнее построена молекула, тем легче и прочнее её упаковка в кристалле и тем выше температура плавления. Так, степень симметрии молекул изомерных пентанов возрастает в следующей последовательности: изопентан, н -пентан, неопентан СН3 ׀ СН3–СН–СН2–СН3, СН3–СН2–СН2–СН2–СН3, СН3–С–СН3, ׀ ׀ СН3 СН3 что вполне соответствует указанной закономерности в температурах плавления (смотри выше).
|

 или
или