Микробные ферментные препаратыФерментные препараты (ФП) получают путем микробиологического синтеза при культивировании различных микроорганизмов-продуцентов: грибов, бактерий, дрожжей и др. Выпускаемые отечественной промышленностью ФП имеют наименования, сочетающие сокращенное название основного в данном препарате фермента и сокращенное видовое название микроорганизма-продуцента. Так, например, препарат, в котором основным ферментом является После наименования микробного ФП вводятся индексы ПЗх, П10х, П15х, П20х или ГЗх, Г10х, Г15х, Г20х. Буквы в этих индексах характеризуют способы выращивания микроорганизма-продуцента: П обозначает выращивание на твердых питательных средах, Г - глубинное выращивание в жидких средах. Обозначения Зх, 10х, 15х, 20х отражают нарастающую степень очистки и концентрации ФП. Зарубежные предприятия выпускают ферментные препараты, в которых либо сохраняется принцип их наименования по основному ферменту и продуценту (например, Фунгамил - амилаза плесневого происхождения), либо по основному ферменту и назначению (например, Пентопан - пентозаназа для хлебопечения), либо используется торговая марка. В культурах грибов и бактерий содержится несколько ферментов: амилолитические, пектолитические, целлюлолитические и др. Моноферментные препараты из микробных культур из-за сложности технологий получения применяются в основном для исследовательских целей, в медицине и др. В микробных ФП промышленного назначения с учетом специфики их действия преобладает активность основного фермента. В случае наличия в препарате не только основного, преобладающего фермента, но и других сопутствующих, устанавливаются их количественное соотношение и активность. Ферментные препараты характеризуются ферментативной активностью, которая выражается в стандартных единицах фермента. Стандартная единица фермента - это такое количество фермента, которое катализирует превращение одного микромоля данного субстрата за одну минуту при заданных условиях. Активность выражается в единицах на 1 г препарата или 1 г белка в препарате. В нормативной документации на ферментные препараты активность ферментов в препарате является основным показателем его биохимических свойств. Так, отечественный ферментный препарат Амилоризин П10х имеет амилолитическую активность: I группа - 2500±250 Е/г, II группа - 2000±200 Е/г. Дозировка ферментных препаратов при обработке однокомпонентных продуктов (например, крахмала под действием глюкоамилазы) осуществляется по единицам активности, многокомпонентных — в % к массе продукта в соответствии с технологическими рекомендациями, разработанными для применения каждого конкретного ферментного препарата. Например, расход препарата Амилоризина П10х для осахаривания мучных заварок составляет при активности 2000Е/г - 0, 007-0, 01% ФП к массе муки в заварке (т. е. 7-10 г ФП на 100 кг муки). В нормативной документации указывается активность сопутствующих ферментов (например, в препарате Амилоризин П10х - протеолитическая активность), регламентируются также микробиологические (количество бактериальной микрофлоры и др.) и физико-химические (крупность, влажность и др.) показатели. Классификация ФП, используемых в хлебопекарной промышленности, в зависимости от назначения и особенностей воздействия представлена на рисунке, а характеристика и функции ФП приведены в таблице. Амилолитические ФП. ФП, проявляющие амилолитическую активность, являются биокатализаторами, увеличивающими скорость гидролиза крахмала, что приводит к увеличению газо- и сахаробразующей способности муки.
Рисунок 25 – Классификация ферментных препаратов по их воздействию на структурные компоненты муки Таблица 1– Функции ферментных препаратов в тестовых системах
свойствами глобулина и имеющий молекулярную массу 45000-60000. Все Препараты Препараты содержат значительные количества тирозина и триптофана. Глютаминовая и аспарагиновая кислоты составляют 25% от массы белка. Наличие аминокислот в Действуя на целое крахмальное зерно,
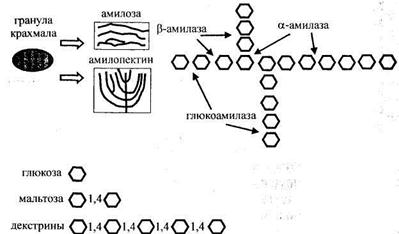
Рисунок 26- Механизм гидролиза крахмала амилолитическими ферментами
Все В зависимости от вида продуцента - микроорганизма свойства амилаз могут сильно отличаться не только по механизму воздействия на субстрат и конечным продуктам, но и по оптимальным условиям для проявления максимальной активности. Основными продуцентами Так, оптимальными условиями действия Ферментные препараты 1. корректировки хлебопекарных свойств муки с пониженной газо- и сахарообразующей способностью, а также с коротко-рвущейся клейковиной; 2. интенсификации процесса брожения при тестоприготовлении (с введением препарата в опару, тесто, закваску); 3. повышения биотехнологических свойств дрожжей с введением препарата в мучную среду на стадии активации, либо для осахаривания заварок, используемых для активации дрожжей, при приготовлении жидких дрожжей, а также заварных сортов хлеба из ржаной муки; 4. улучшения качества, вкуса и запаха хлеба при интенсивных технологиях его производства. В этом случае использование фермента 5. снижения черствения хлеба при хранении. В ФП Амилосубтилин Г10х бактериальная Для снижения термостабильности препарата производят мультэнзимную композицию, в состав которой входят амилазы грибного и бактериального происхождения - Амилоризин П10х и Амилосубтилин Г10х - 100: 3. Наиболее эффективное действие наблюдается при добавлении композиции к муке с упругой, недостаточно эластичной клейковиной, с пониженной и нормальной сахаробразующей способностью (180-250 мг мальтозы на 10 г муки) и автолитической активностью до 30 %. За рубежом производятся препараты мальтогенной амилазы (Новамил, компания «Новозаймс», Дания), полученной при культивировании генетически модифицированного штамма Bacillus subtilis, отличающегося пониженной термостабильностью по сравнению с Амилосубтилином и способностью гидролизовать крахмал с образованием декстринов в начальный период выпечки, что существенно замедляет скорость ретроградации крахмала и черствение мякиша пшеничного хлеба при хранении. Эффект снижения черствения хлеба при применении бактериальной В качестве источника В прорастающем зерне происходит активация и образование ферментов - в наибольшей степени Солод неферментированный, содержащий амилолитические ферменты, применяется в хлебопекарном производстве для осахаривания заварки при приготовлении заварных сортов хлеба (рижский и др.), улучшения качества пшеничного хлеба из муки с пониженной сахаро- и газообразующей способностью, для осахаривания заварок при приготовлении жидких дрожжей, заквасок. Вместо измельченного неферментированного солода применяются также солодовые экстракты в количестве 1-3% к массе муки, содержащие ферменты, сахара и декстрины, растворимые составные части активного белого солода без оболочек и крупных частиц зерна. Применение солодовых экстрактов широко распространено в ряде стран (например, Мальтазим в Финляндии).
Глюкоамилаза катализирует последовательное отщепление концевых остатков Почти все глюкоамилазы являются гликопротеидами, содержащими от 5 до 35% углеводов, которые состоят из олиго-, ди- и моносахаридов. Углеводный компонент может быть целостным фрагментом или же разбитым на индивидуальные соединения, которые прикрепляются к белку через треонин и серин. Из глюкоамилазных ферментных препаратов в хлебопекарном производстве используются в основном препараты, продуцентами которых являются Aspergillus awamori и Aspergillus niger. Оптимальные условия действия фермента этих препаратов: рН 4, 2-4, 5, температура - 60-65 0С. Учитывая, что фермент глюкоамилаза наиболее активен при низких значениях рН, для накопления глюкозы в мучных средах его вводят в кислотосодержащие полуфабрикаты - закваски. Однако наиболее результативен гидролиз клейстеризованного крахмалсодержащего сырья при оптимальных условиях действия фермента. Это позволило разработать технологии (Р.Д. Поландова, А.С. Демидов) приготовления ВФП - высокоосахаренных ферментативных полуфабрикатов (65-75% глюкозы на с.в.) путем гидролиза глюкоамилазой вторично перерабатываемого хлеба (черствого, деформированного и др.), муки различных сортов и видов (пшеничной, ржаной, тритикале), в т.ч. с пониженными свойствами (из проросшего зерна, поврежденного клопом-черепашкой, морозобойного). Основные пути применения ВФП: - в качестве сахарсодержащего компонента рецептуры изделий; для повышения биотехнологических свойств дрожжей - жидких, сушеных, прессованных при их активации; для улучшения качества, вкуса и запаха хлеба, особенно при интенсивных технологиях его производства, а также из муки с пониженной сахарообразующей способностью и др. При введении препаратов глюкоамилазы в полуфабрикаты из ржаной муки с повышенной автолитической активностью снижается количество декстринов, улучшаются свойства мякиша хлеба (отсутствуют липкость и заминаемость). Эффективность использования глюкоамилазы повышается при применении совместно с препаратами Значительным недостатком применения амилолитических препаратов является их сопутствующая протеолитическая активность, что затрудняет их использование при переработки муки с пониженным содержанием клейковины, а также слабой по силе. Хлебные изделия лучшего качества получаются при совместном внесении амилолитических ФП и УОД. Препараты Fungamyl BG, приготовленный на основе очищенной грибковой амилазы (оптимум рН 4, 5-5, 0, температуры 53-55 0С), Bioferm P, Biobak P conc, Grindamyl A 1000 характеризуютсянизким уровнем амилоглюкозидазной и протеиназной активности, что позволяет применять их при переработке муки с различными хлебопекарными свойствами. Fungamyl Super АХ, Biobake 721 и Grindamyl S 100 разработаны для коррекции низкой амилолитической активности муки, а также для улучшения структуры мякиша, повышения объёма хлебобулочных изделий и продления срока сохранения свежести. В дополнение к Grindamyl MAX-LIFE U4 – ферментный комплекс, состоящий из грибной и бактериальной амилазы, разработанный для замедления черствения хлебных изделий, вырабатываемых опарными способами. Внесение данного препарата приводит к улучшению показателя стабильности теста. Препарат Grindamyl MAX-LIFE Е5 грибного происхождения наиболее эффективен для ускоренных процессов. Гемицеллюлазные ФП. В последние годы применяются препараты гемицюллюлаз микробного происхождения, гидролизующие полисахариды клеточных оболочек растительных материалов. Известно, что расщепление гемицеллюлоз осуществляется сложным комплексом ферментов, из которых выделены пентозаназы, гидролизующие нерастворимые высокомолекулярные пентозаны. Пентозаны, по данным ряда исследователей, имеют разветвленное строение и состоят из остатков ксилоз и арабиноз с небольшим количеством остатков глюкуроновой кислоты. Предполагается, что ферментативный гидролиз пентозанов осуществляется по меньшей мере четырьмя энзиматическими системами: арабинозидазой, эндоксиланазой, экзоксиланазой и ксилобиазой с образованием через ряд промежуточных сопряженных реакций арабинозы и ксилозы. При этом повышается количество растворимых низкомолекулярных пентозанов, что способствует образованию более прочного клейковинного каркаса. Ферментные препараты гемицеллюлаз отечественного производства в России получены при культивировании гриба Trichothecium roseum, Aspregillus awamori, Chaetomium cellulyticum и др. Внесение гемицеллюлазы в оптимальных дозировках способствует увеличению доли связанной влаги в тесте, что приводит к увеличению ВПС полуфабрикатов, улучшению структурно-механических свойств теста, повышению удельного объёма хлеба на 15-32% по сравнению с контрольным образцом. В последние годы получены препараты пентозаназы (ксиланазы), продуцентом которых является Aspergillus oryzae (например, Пентопан компания «Новозаймс», Дания). Исследования показали, что применение пентозаназы приводит к повышению объёма и улучшению структуры мякиша пшеничного хлеба. Механизм улучшающего действия объясняется повышением содержания растворимых пентозанов, образованием гелей, а также усилением взаимодействия арабиноксиланов и белков клейковины. Установлен положительный эффект применения ферментного препарата ксиланазы - Пентопан 500 БГ при приготовлении хлеба из смеси ржаной и пшеничной муки за счет воздействия её на водо- и щелочерастворимые пентозаны, перераспределения их фракционного состава, увеличения количества сбраживаемых сахаров, что приводит к улучшению реологических свойств теста и качества хлеба. Считается, что результат действия пентозаназы аналогичен влиянию поверхностно-активных веществ в тесте. Использование мультэнзимных композиций, содержащих препараты пентозаназы и амилазы, либо пентозаназы и глюкоамилазы, приводит к повышению эффективности их применения, очевидно, в результате синергизма действия в тестовой системе. Ферментные препараты Biobake 710, Biobake 721 (Нидерланды) также обладают гемицеллюлазной активностью. Отечественный цитолитический ФП Цитороземин П10х, продуцентом которого является культура грибов Trichothecium rozeum, обладает гемицеллюлазной, целлобиазной, пентозаназной активностями приводит к увеличению объёмного выхода хлеба. Протеолитические ФП разделяются на: пептидазы и протеиназы. Субстратами для действия протеолитических ферментов являются пептиды и белки. Пептиды имеют более низкую молекулярную массу, чем белки, и по составу подобны простым белкам, Они могут быть либо продуктами неполного гидролиза белка, либо природными соединениями. К белкам относятся простые белки, состоящие только из аминокислот (протеины), и сложные белки, в состав которых наряду с белковой частью молекулы входят соединения небелковой природы (углеводы, витамины, жиры и др.) (протеиды). Все эти соединения имеют большую молекулярную массу и сложны по строению. В группе протеолитических ферментов - пептидазах - подразделение по подклассам осуществляется на основе механизма расщепления пептидных связей в пептидах. Вторая группа протеолитических ферментов - протеиназы - имеет четыре подкласса, в котором все ферменты подразделяются в зависимости от особенностей механизма катализа, установленного по функционированию активного центра фермента, а также влиянию рН на его активность. Из них значение имеют кислые протеиназы, имеющие оптимальный рН ниже 5. К ним относятся наиболее известные кислые протеиназы грибного происхождения, а также различные нейтральные протеиназы, содержащие ионы металлов. В основном протеолитические ферменты микробного происхождения обладают способностью гидролизовать пептидные связи в белках различного состава и происхождения, способствуя образованию низкомолекулярных азотистых веществ, используемых для питания, в результате чего усиливается процесс гидролиза полуфабрикатов. Так, они способны расщеплять желатин, казеин, гемоглобин, альбумин, растительные белки и др. В отечественном хлебопечении используются протеолитические ферментные препараты Проторизин П10Х и Протосубтилин Г10х и зарубежные препараты бактериального происхождения (Нейтраза, «Новозаймс», Дания). Оптимальные условия действия протеиназ - температура 45-55 0С, рН 5, 5-7, 5. Сопутствующим ферментом в протеолитических препаратах является Разработана также мультэнзимная композиция Протозим, содержащая протеиназу бактериальную и Протеолитические ферментные препараты влияют на свойства теста, вызывая «ослабление» его структуры, что особенно важно для улучшения качества хлеба из пшеничной муки с крепкой, короткорвущейся клейковиной, т.к. ферменты этой группы, проявляя восстановительную активность, оказывают деструктурирующее действие на клейковину муки. Протеолитические препараты применяются также для повышения технологических свойств белоксодержащих добавок (например, гидролиза белков продуктов переработки сои в специально приготовленных полуфабрикатах) при производстве изделий повышенной биологической ценности; для улучшения реологических свойств теста и качества бездрожжевых слоеных изделий, мучных кондитерских изделий (крекеров, галет, бисквитов). Ферментные препараты, интенсифицирующие окислительные процессы при приготовлении теста. Среди различных процессов, происходящих при приготовлении теста и обусловливающих качество хлеба, значительная роль принадлежит окислительным процессам. Они лежат в основе ряда мероприятий, применяемых в практике хлебопекарного производства и направленных на улучшение качества хлеба: хранение муки после помола, приводящее к её «созреванию», применение химических улучшителей окислительного действия, интенсивный замес теста и др. Перспективными являются методы улучшения качества хлеба с использованием ферментов глюкозооксидазы и липоксигеназы, катализирующих реакции окисления с образованием различных пероксидов, далее окислительно воздействующих на структурные компоненты муки в процессе тестоприготовления. В настоящее время значение этих ферментов для хлебопекарного производства повышается в связи с необходимостью замены улучшителя окислительного действия - бромата калия, исключенного из списка разрешенных пищевых добавок. ФП глюкозооксидазы. Фермент глюкозооксидаза катализирует окисление
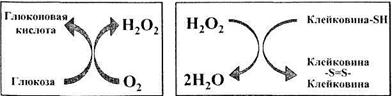
Рисунок 27 – Схема действия фермента глюкозооксидазы
Перекись водорода, являясь окислителем, воздействует на -SH-содержащие клейковинные белки с образованием дополнительных -S=S- связей в структуре клейковины, что укрепляет структуру клейковины и улучшает реологические свойства теста (рис).
Рисунок 28- Механизм окислительного действия глюкозооксидазы на клейковинные белки в тесте
Дополнительное воздействие перекиси водорода заключается в модификации некрахмальных углеводов второго порядка. В соответствие с теорией Л. Хилхорста и др. возможно образование поперечных связей арабиноксилана при помощи феруловой кислоты с другими арабиноксиланами. Окисление феруловой кислоты приводит к образованию дополнительных связей (дополнительное связывание феруловой кислоты), способствует гелеобразованию, увеличивает гидратацию, в результате чего возрастает водопоглотительная способность теста (рис).
Рисунок 29- Дополнительное воздействие перекиси водорода на арабиноксилановую фракцию пшеничной муки в тесте
Для производства ферментного препарата глюкозооксидазы применяют различные виды микроскопических грибов, относящиеся преимущественно к роду Penicillum {Penicillum notation, Penicillum vitale и др.) и реже к роду Aspergillus {Aspergillus niger). Препараты глюкозооксидазы содержат сопутствующий фермент каталазу. Оптимум действия ферментного препарата глюкозооксидазы, полученного в Институте биохимии АН Украины при культивировании P. vitale для пищевой промышленности, находится в зоне рН 5, 6-5, 8, при рН 3, 0 сохраняется 30% её активности. Температурный оптимум - 30-40 0С, при температуре 10 0С фермент активен не более, чем на 50%, при 65 0С - полностью инактивируется. Глюкозооксидаза Penicillium vitale стабильна в водном растворе при температуре 25-27 0С, при температуре 35 0С за 5 ч фермент утрачивает 20-25% активности. В сахарных и солевых растворах глюкозооксидаза инактивируется. Установлено, что улучшение качества хлеба с глюкозооксидазой достигается при ее совместном применении с аскорбиновой кислотой. Была выдвинута гипотеза механизма действия фермента в тесте, заключающаяся в том, что образующаяся при окислении глюкозы перекись водорода способствует переходу аскорбиновой кислоты в дегидро-L-аскорбиновую кислоту, окислительно воздействующую через ряд сопряженных реакций на белково-протеиназный комплекс муки, что приводит к укреплению свойств теста и качества хлеба. Применение глюкозооксидазы совместно с аскорбиновой кислотой рекомендуется для муки с нормальной и слабой, излишне растяжимой клейковиной. В связи с необходимостью наличия в среде глюкозы для действия глюкозооксидазы фермент используют для улучшения качества булочных и сдобных изделий. При производстве хлеба (без сахара) применение глюкозооксидазы с аскорбиновой кислотой эффективно при совместном применении препаратов глюкозооксидазы и глюкоамилазы. В ГосНИИХП разработаны способы применения ферментного препарата глюкозооксидазы совместно с аскорбиновой кислотой, обеспечивающие улучшение качества хлебобулочных изделий при интенсивной («холодной») технологии. Эффективность применения глюкозооксидазы повышается при введении ее совместно с аскорбиновой кислотой в дрожжевую смесь с небольшим количеством сахара с последующим замесом теста. Установлена возможность частичной замены аскорбиновой кислоты (50-75%) ферментным препаратом глюкозооксидазы при соотношении «количество заменяемой аскорбиновой кислоты»: «ферментный препарат глюкозооксидазы» - 10: 1, что объясняется синергическим эффектом их совместного применения. ФП Gluzyme (Дания) является препаратом глюкозооксидазы с активностью фермента каталазы, продуцируемой штаммом Aspergillus niger. Он может быть использован в качестве добавки, обеспечивающей сильное окислительное воздействие, аналогичное бромату калия.Его внесение при замесе теста вызывает окисление свободных -SH- в структуре клейковинных белков, в результате чего образуются -S=S-, способствующие укреплению теста, увеличению его эластичности, объёма изделий. Gluzyme активен в тесте, инактивируется в процессе выпечки, стабилен при рН 3, 5-7, 0 и при температуре 50-60 0С. Ферменты окислительного действия (оксидазы, пероксидазы) содержат ФП серии Biobake Soy (Нидерланды). Их применение при приготовлении хлеба приводит к улучшению газоудерживающей способности и стабильности тетса, повышению его водопоглотительной способности, улучшению качества готовых изделий. Фермент липоксигеназа. Фермент липоксигеназа катализирует окисление цис-формы линолевой, линоленовой и арахидоновой ненасыщенных жирных кислот. Окисление ненасыщенных жирных кислот под действием липоксигеназы приводит через ряд промежуточных стадий к образованию, в основном, гидроперекисей, являющихся активными окислителями. Продукты ферментативной реакции участвуют в окислении -SH- групп компонентов белково-протеиназного комплекса муки, улучшая структурно-механические свойства теста, а также в окислении и обесцвечивании пигмента эндосперма в муке и отбеливании мякиша хлеба. Фермент липоксигеназа широко распространен в объектах растительного происхождения - обнаружен в стеблях и семенах бобовых (сое, горохе, фасоли, зеленом горошке, конских бобах), в злаковых (пшенице, ржи, овсе, ячмене), в масличных культурах (подсолнечнике, льне), в овощах и кормовых травах, картофеле. Наиболее высокую активность липоксигеназы имеют семена бобовых (семядоли и ростки), а из них семена сои; у гороха она ниже в 3—10 раз, у пшеницы - в 10-20 раз и более, чем у семян сои. В США производится хлебопекарный улучшитель Vytasc, имеющий в основе липоксигеназноактивную соевую муку. Добавки его в количестве до 1 % к массе муки увеличивают объем хлеба, улучшают структуру, реологические свойства и цвет мякиша. В России разработано несколько способов улучшения качества хлеба, основанных на использовании ферментативно - активной соевой муки. К ним относится ферментный способ улучшения качества хлеба (Л.Я. Ауэрман, В.Л. Кретович, Р.Д. Поландова), по которому предусматривается приготовление специальной жидкой окислительной фазы (ЖОФ) из воды, ферментативно - активной соевой муки, растительного масла и пшеничной муки. Хлеб, приготовленный ферментным способом, по всем показателям качества (объём, пористость, формоустойчивость) был лучше хлеба, полученного традиционным способом. Отмечается более светлый, эластичный мякиш с мелкой тонкостенной пористостью. Исследования альтернативных источников фермента липоксигеназы показали её высокую активность (в 2-5 раз выше, чем в пшеничной муке) в клеточном соке картофеля (КСК) - отходе картофеле - крахмального производства. Показано, что КСК и его препараты целесообразно вносить не только в ЖОФ, но и в фазу активации прессованных дрожжей. Пшеница и пшеничная мука обладают, хотя и сравнительно низкой, но все же практически значимой липоксигеназной активностью. При этом активность липоксигеназы пшеничной муки тем выше, чем выше зольность и содержание белка в ней. Содержащаяся в пшеничной муке липоксигеназа может окислять при участии кислорода соответствующие ненасыщенные жирные кислоты муки. На этом основан способ улучшения качества хлеба с использованием в ЖОФ вместо соевой муки в качестве источника липоксигеназы пшеничной муки (М.П. Попов, Г.Г. Дубцов). На основе ферментативно - активной (липоксигеназной) соевой муки разработаны комплексные хлебопекарные улучшители, широко используемые в хлебопечении ряда стран - Англии, Франции, Германии, США, России. Липолитические ферментные препараты (липаза). Механизм действия фермента липазы в упрощенном виде сводится к гидролизу триацилглицеридов с присоединением воды и образованием моно- и диглицеридов и свободных жирных кислот и глицерина. Наиболее перспективным источником липаз являются микроорганизмы - бактерии, актиномицеты, грибы, дрожжи. При этом бактерии накапливают в основном внутриклеточную липазу, а актиномицеты, грибы и дрожжи - внеклеточную. В зависимости от оптимального рН липазы делятся на кислые (4-6), нейтральные (6, 5-7, 2) и щелочные (7, 5-9), температурный оптимум отмечается в диапазоне от 30 до 40 °С. В последние годы получены промышленные препараты липазы для целей хлебопечения. Установлено, что применение препаратов липазы приводит к улучшению реологических свойств теста и качества хлеба, а также продлевает срок свежести готовых изделий. Показано, что эффективность действия ферментного препарата зависит от хлебопекарных свойств муки, наличия в рецептуре жировых продуктов (в основном растительных масел), использования липазы совместно с липоксигеназой. Использование препарата липазы позволяет уменьшать содержание жировых продуктов в рецептуре хлеба без снижения показателей качества готовых изделий. Улучшающее действие препаратов липазы объясняется рядом факторов, в т.ч. повышением количества свободных липидов в тесте и снижением количества связанных липидов муки; образованием при гидролизе моно- и диглицеридов, являющихся поверхностно-активными веществами; образованием перекисей и гидроперекисей в результате окисления под действием липоксигеназы пшеничной или соевой муки ненасыщенных жирных кислот (продуктов гидролиза жиров и масел) с последующим их воздействием на белково-протеиназный комплекс муки. При применении липазы увеличивается объем хлеба, улучшаются свойства и цвет (осветление) мякиша. Перспективным является применение в хлебопечении ферментного препарата фосфолипазы, катализирующего гидролиз фосфолипидов с образованием продуктов, вступающих во взаимодействие с углеводами (моно- и трисахаридами) и белками муки с образованием липопротеидных комплексов, улучшающих реологические свойства теста и качество хлеба из пшеничной муки. При внесении в тесто липазы, продуцируемой Rhyzopus delemar, замедляется черствение хлеба. Применение препарата Novozym 667 BG, продуцентом которого является генетически модифицированный штамм Aspergillus oryzae, позволяет увеличивать стабильность теста и объём хлеба, улучшать структуру пористости и цвет мякиша. Ферментные препараты
|

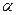 -амилаза, полученная культивированием Aspergillus oryzae, именуется Амилоризином. Если продуцентом такого препарата является культура Bacillis subtilis, то такой ФП называется Амилосубтилином.
-амилаза, полученная культивированием Aspergillus oryzae, именуется Амилоризином. Если продуцентом такого препарата является культура Bacillis subtilis, то такой ФП называется Амилосубтилином. -амилаза является эндоамилазой, вызывающей гидролитическое расщепление
-амилаза является эндоамилазой, вызывающей гидролитическое расщепление 


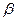 -глюканаза, пентозаназа).
-глюканаза, пентозаназа).