Общее условие химического равновесияВ случае смеси веществ, а таковой является, например, смесь исходных веществ и продуктов химической реакции nА А + nВ В ⇄ nС С + nD D, функция Гиббса будет зависеть не только от давления и температуры, но и от количества веществ n A, n В, n С, n D участников реакции G = f (p, T, n A, n В, n С, n D). (4.46) Полный дифференциал функции Гиббса

Знак (-) в уравнении (4.47) означает, что количество n A и n В моль исходных веществ в процессе достижения химического равновесия уменьшается, а продуктов реакции n С и n D увеличивается. При постоянном составе системы, согласно уравнениям (4.43) и (4.44), частные производные равны энтропии и объему системы в целом
а частные производные функции Гиббса
есть химические потенциалы компонентов смеси (символ i обозначает компоненты А, В, С и D, а символ j обозначает компоненты, концентрация которых не меняется при изменении концентрации компонента i). Выражение (4.47) можно представить в виде: dG = Vdp - SdT - m A dn A - m B dn B + m C dn C + m D dn D. Если химическое равновесие устанавливается при постоянной температуре и давлении (р, Т = const), то dG = - m A dn A - m B dn B + m C dn C + m D dn D. (4.48) Условимся считать, что химические потенциалы mi не зависят от количества моль компонентов смеси. Тогда интегрирование функции Гиббса от G1 до G2, а количества моль реагентов и продуктов реакции от 0 до ni дает:
D G = - nА m A - nВ m B + nС m C + nD m D, D G = Sni m i. (4.49) При достижении равновесия D G = 0, и уравнение (4.49) примет вид: Sni m i = 0. (4.50) Уравнение (4.50) в общей форме выражает условие химического равновесия. Зная, что mi= mi0+ RT ln pi,, получаем Sni m i = - nА m 0A - nА RT ln pA - nВ m 0B - nВ RT ln pB + nС m 0C + nС RT ln pC + nD m 0D + nD RT ln pD = 0 или
В правую часть уравнения (4.51) входят постоянные параметры, если принять во внимание, что процесс проводят при постоянной температуре (Т = const). Тогда из уравнения (4.51) следует
Кр – константа равновесия химической реакции, pA, pB, pC, pD – парциальные давления компонентов смеси. Уравнение (4.52) является одной из форм выражения закона действующих масс. В случае неравновесного состояния системы следует пользоваться уравнением (4.49). Если подставить в уравнение D G = Sni m i химические потенциалы участников реакции, то получим уравнение изотермы реакции Вант-Гоффа:
В уравнении изотермы реакции (4.53) даны произвольные неравновесные парциальные давления участников реакции. В случае равенства всех неравновесных давлений единице (стандартное условие) уравнение изотермы приобретает вид: - Рассмотрим выражения константы равновесия гомогенной и гетерогенной реакций. Для гомогенной реакции образования аммиака, протекающей в газовой фазе, N2(г) + 3H2(г) ⇄ 2NH3(г)
В случае гетерогенной реакции, наряду с газообразными веществами, участвуют конденсированные фазы, каждая из которых состоит только из одного компонента (чистого вещества). Например, СаСО3(т) ⇄ СаО(т) + СО2(г) в газовой фазе отсутствуют пары твердых веществ СаСО3 и СаО. Тогда, согласно уравнению (4.50), условие химического равновесия запишется следующим образом:
или
Аналогично для равновесной реакции С(т) + СО2(г) ⇄ 2СО(г), выражение константы химического равновесия примет вид:
Таким образом, в случае гетерогенной реакции в выражение константы равновесия входят парциальные давления только газообразных участников реакции.
|

 ,
, ,
,
 ,
, . (4.51)
. (4.51) . (4.52)
. (4.52) . (4.53)
. (4.53) или
или 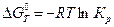 . (4.54)
. (4.54) .
. = 0
= 0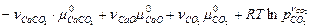 = 0,
= 0, или
или
 .
. .
.


