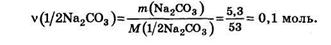Моль. Молярная масса. Химический эквивалент. Молярная масса эквивалента. Фактор эквивалентности
Единицей измерения количества вещества в СИ (системе интернациональной) является моль. Моль (ν) — это количество вещества, которое содержит столько же частиц (атомов, молекул, ионов или других), сколько содержится атомов углерода в 0, 012 кг (12 г) изотопа углерода-12. Количество вещества X записывается как ν (X). Например, ν (KMnO4) = 0, 2 моль; ν (Ca2+) = 2 моль. 1 моль СаСl2 содержит 1 моль Са2+ (6, 02 • 1023 ионов кальция) и 2 моль Сl- (2 • 6, 02 • 1023 ионов хлора). Молярная масса (мольная масса) — это масса одного моль вещества. Молярную массу М(Х) вычисляют как отношение массы (т) вещества к его количеству v(X).
M(Х) = m(X) / ν (X) (19.1)
Химический эквивалент - это некая реальная или условная частица, которая эквивалентна одному иону водорода в кислотно-основных реакциях или одному электрону в окислительно-восстановительных реакциях. Рассмотрим реакции: а) Н+ + ОН- = Н2О; б) 2Н+ + S2- = H2S; b)H+ + NH3= NH4; г) 3ОН- + Н3РО4 = РО43- + 3Н2О; д) Н2 - 2ē = 2Н+; е) Аl3+ + 3ē = Al0
В кислотно-основных реакциях а) - г) одному иону Н+ эквивалентны 1 ион ОН-, 1/2 HOHaS2-, 1 молекула NH3, 1/3 молекулы Н3РО4. В окислительно-восстановительных реакциях д), е) одному электрону эквивалентны 1/2 молекулы Н2, 1/3 иона Аl3+. Перечисленные частицы рассматриваются как эквиваленты веществ, участвующих в этих реакциях. В другой формулировке эквивалент - это некая реальная или условная частица, которая в реакции обмена или окисления-восстановления эквивалентна одному элементарному заряду. Например, в реакции Н3РО4 + ОН- = Н2РО4 + Н2О эквивалент соответствует одной молекуле Н3РО4, так как она реагирует с одним ионом ОН-. А в реакции Н3РО4 + 2ОН- = НРО42- + 2Н2О молекула Н3РО4 реагирует с двумя ионами ОН-, значит, здесь эквивалент фосфорной кислоты соответствует 1/2 молекулы Н3РО4. Молярная масса эквивалента вещества X - это масса одного моля эквивалента этого вещества, МЭ(Х). Между молярной массой М(Х), молярной массой эквивалента МЭ(Х) и числом моль ионов водорода (в кислотно-основной реакции) или числом моль электронов (в окислительно-восстановительной реакции) имеется соотношение: МЭ(Х) = М(Х)/ z. (19.2)
где z - число моль ионов водорода или число моль электронов. Число z часто приравнивают к числу ионов водорода или к числу электронов. Величина 1/z называется фактором эквивалентности: f экв (X) = 1/z (19.3)
Величина z всегда целое положительное число, а фактор эквивалентности - меньше или равен единице. С введением фактора эквивалентности молярная масса эквивалента вещества (X) обозначается М(1/zХ). С учетом формул (19.2) и (19.3), молярная масса эквивалента вещества (X) равна произведению фактора эквивалентности на молярную массу вещества (X):
Единица измерения молярной массы эквивалента вещества - кг/моль, г/моль. Чаще используется г/моль. Например, молярная масса эквивалента Na2CO3 в реакции Na2CO3 + НСl = NaHCO3 + NaCl равна: M(Na2CO3) = 1 • 106, 0 г/моль = 106, 0 г/моль. В реакции Na2CO3 + 2HCl = NaCl + H2O + СО2 молярная масса эквивалента Na2CO3 равна: M(1/2Na2CO3) = 1/2 • 106, 0 г/моль = 53, 0 г/моль. Количество вещества (в молях), в котором частицами являются эквиваленты, называется количеством вещества эквивалента ν (1 /z • X):
ν (1 /z • X) = m(Х)/ M(1/z • X) (19.5)
Фактор эквивалентности одного и того же вещества может иметь разные значения в разных реакциях. Рассмотрим это на следующих примерах. В кислотно-основных реакциях Na2CO3 можно нейтрализовать кислотой до кислой соли или до выделения СО2:
а) Na2CO3 + HCl = NaHCO3 + NaCl, f экв(Na2CO3) = 1; б) Na2CO3 + 2HCl = 2NaCl + H2O + CO2, f экв (Na2CO3) = 1/2.
В окислительно-восстановительных реакциях КМnО4 всегда является окислителем:
в) 5Na2SO3 + 2KMnO4 + 3H2SO4 = 5Na2SO4 + 2MnSO4 + 3Н2О + K2SO4, MnO4 + 8H+ + 5ē → Mn2+ +4H2O, f экв (KMnO4) = 1/5; r) 3Na2SO3 + 2KMnO4 + H2O = 3Na2SO4 + 2MnO2 + 2KOH, MnO4 + 2H2O + 3 ē → MnO2 +4OH-, f экв (KMnO4) = 1/3; д) Na2SO3 + 2KMnO4 + 2KOH- = Na2SO4 + 2K2MnO4 + H2O; MnO-4 + ē → MnO2-4, f экв (КМnО4) = 1.
Степень окисления марганца в продуктах реакций в) - д) определяется кислотностью среды: чем ниже кислотность (выше рН) среды, тем слабее окислительная способность перманганата. Из рассмотренных примеров следует, что при использовании терминов «эквивалент» и «фактор эквивалентности» вещества всегда необходимо указывать, к какой конкретной реакции они относятся. Если требуется рассчитать количество вещества эквивалента безводной соды в ее навеске массой 5, 3 г при проведении реакции с соляной кислотой до СО2 (см. уравнение реакции б), то пользуются уравнением (19.5): v(l/2Na2CO3)=
|