БИЛЕТ №10Вопрос 1. Карбоновые кислоты. Их строение, свойства, получения и применение.
Ответ. Карбоновые кислоты- органические соединения, в молекулах которых содержаться одна или несколько карбоксильных групп (СООН), соединенных углеводородным радикалом (или атомом водорода).
Гомология Общая формула: CnH2n+1 COOH, или R-COOH (у первого гомолога вместо R- атом водорода).
Номенклатура Название кислот производят от названий соответствующих углеводородов с прибавлением окончания «-овая» и слово «кислота».
Например: СН4 - HCOOH, метан метановая(муравьиная) кислота С2H6 - CH3COOH, этан этановая (уксусная) кислота С3H8 - CH3CH2COOH. пропан пропановая(пропионовая) кислота
Изомерия а) Изомерия углеродного скелета (С
СH3-CH2-CH2-COOH, бутановая (масленая) кислота
CH3-CH(CH3)-COOH. 2-метилпропановая (изомасляная) кислота
б) Межклассовая изомерия:
CH3CH2COOH, пропановая кислота
CH3COOCH3. метиловый эфир уксусный кислоты (метилацетат)
Физические свойства Карбоновые кислоты с С1 по С8 – бесцветные жидкости с резким запахом, более С9 – твердые; с С1 по С3 – хорошо растворимы в воде, с С3 по С8 – малорастворимые, более С9 – нерастворимые. Все карбоновые кислоты – слабые электролиты. Химические свойства Многие свойства карбоновых кислот обусловлены наличием в их молекулах карбоксильных групп. В карбоксильной группе атом кислорода, связанный с атомом углерода двойной связью, оттягивает электроны на себя. При этом атом углерода приобретает положительный заряд и притягивает электроны второго атома кислорода (из группы ОН). Это приводит к сдвигу электронного облака связи О-Н в направлении атома кислорода, так что атом водорода становится подвижным и реакционноспособным.
О-Н
В результате взаимного влияния атомов связь О-Н в карбоновых кислотах менее прочная, чем в спиртах. Карбоновые кислоты обладают высокими температурами кипения, что связанно с образованием водородных связей между молекулами: ••• О=С- ОН•••О=С-ОН•••О=С-ОН•••
R R R Свойства минеральных кислот 1. Диссоциация в водном растворе:
CH3COOH=H++ CH3COO- . 2. Взаимодействие с металлами, основными оксидами, основаниями, солями:
CH3COOH+K(K2O, KOH, K2CO3)→ → CH3COOK+H2(H2O, H2O, H2O+CO2).
Свойства органических кислот
3. Этерификация: CH3COOH+CH3OH метиловый эфир уксусной кислоты 4. Образование ангидридов кислот: R-COOH+HOOC-R ангидрид 5. Галогенирование: CH3COOH+Cl2=CH2(Cl)COOH + HCl. монохлоруксусная кислота
Атомы водорода в молекулах карбоновых кислот, стоящие при атоме углерода, соседнем с карбоксильной группой, легко замещаются на атомы хлора или брома, т.к. их подвижность увеличивается под влиянием карбоксильной группы. 6. Реакция серебряного зеркала:
HCOOH+Ag2O=CO2↑ +H2O+2Ag↓. Реакция идет только с HCOOH, так как только в ее молекуле присутствует альдегидная группа. О -С Н. 7. Разложение: HCOOH H2SO4
Получение
1. Из соли: 2CH3COONa+H2SO4=2CH3COOH+Na2SO4. 2. Окисление алкана: 2СH4+3O2=2HCOOH+2H2O. 3. Окисление спирта: R-CH2OH+O2=R-COOH+H2O. 4. Окисление альдегида: R-CHO+[O]=R-COOH альдегид окислитель 5. Из оксида углерода(II) и гидроксида натрия: CO+NaOH p формиат натрия 2HCOONa+H2SO4=2HCOOH+Na2SO4.
6. Из спирта и оксида углерода(II): СH3OH+CO p 7. Гидролиз нитрилов: CH3C≡ N+2H2O=CH3COOH+NH3. Применение 1. HCOOH – в синтезе органических веществ (как восстановитель), в пищевой отрасли промышленности (как антисептик и консервант), в текстильной отрасли промышленности (при крашении тканей), в медицине (как средстве для растирания). 2. CH3COOH – для получения пластмасс, красителей, лекарственных веществ, искусственного волокна (ацетатный шелк), невоспламеняющейся кинопленки. Ее соли – гербициды. Ее сложные эфиры используются в парфюмерии и медицинской отрасли промышленности. 3. C15H31COOH и C17H35COOH – для получения мыл.
|

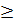 4):
4):

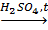 CH3COOCH3+H2O.
CH3COOCH3+H2O. R-COOOC-R+H2O.
R-COOOC-R+H2O.


