Решение. 1. Влияние концентраций (парциальных давлений) компонентов системы1. Влияние концентраций (парциальных давлений) компонентов системы. Если, например, в систему добавить метан, т.е. увеличить его концентрацию, то равновесие системы нарушится. При этом ускорится прямая реакция, что приведет к увеличению концентрации продуктов реакции СО2 и Н2 и уменьшению концентрации водяного пара, т.е. равновесие смещается вправо. Процесс будет протекать до тех пор, пока не установится новое равновесие, характеризующееся тем же значением Кс. Если в систему ввести дополнительное количество СО2 или Н2, то в соответствии с принципом Ле-Шателье равновесие сместится влево. 2. Влияние общего давления в системе. Если в результате реакции изменяется число молей газообразных веществ, то изменение общего давления в системе вызывает смещение равновесия. В соответствии с принципом Ле-Шателье увеличение общего давления в системе вызывает смещение равновесия в сторону уменьшения числа молей газообразных веществ, т.е. в сторону уменьшения давления. Для рассматриваемой реакции увеличение давления должно смещать равновесие влево (слева Σ ν i = 3, справа Σ ν i = 5). 3. Влияние температуры. С увеличением температуры равновесие смещается в сторону эндотермических реакций, т.е. реакций, протекающих с поглощением теплоты. Как указывалось ранее, повышение температуры вызывает увеличение константы равновесия эндотермической реакции, а соответственно возрастают отношения концентраций продуктов реакции к концентрациям исходных веществ, т.е. равновесие смещается в сторону эндотермических реакций. Например, увеличение температуры вызывает смещение равновесия рассматриваемой реакции получения водорода (Δ Η > 0) в правую сторону, а для экзотермической реакции 2Н2 + О2 = 2Н2О (Δ Η < 0) – в левую сторону. Пример 4. Равновесие в гомогенной газовой системе 2А+3В«3С+D установилось в момент, когда прореагировало 50% вещества А. Вычислить константу равновесия, если концентрации исходных веществ С0А=0, 6 моль/л и С0В = 1, 0 моль/л. В какую сторону сместится равновесие при повышении давления? Решение. Для расчета константы равновесия необходимо найти равновесные концентрации исходных веществ и продуктов реакции. 1. Введем обозначения: [А], [В], [С], [D] – равновесные концентрации веществ, моль/л; [В]прореаг. – количество прореагировавшего вещества В, моль/л. к моменту равновесия прореагировало 50% вещества А, [А]=С0А× 0, 5=0, 6× 0, 5=0, 3. 2. Согласно уравнению реакции 2А+3В«3С+D вещество В прореагировало в 3. Исходя из сравнения коэффициентов, можно сделать вывод, что [С]=[В]прореаг.=0, 45 моль/л, [D]= 4. Составим выражение для константы равновесия системы
5. Уравнение реакции 2А+3В«3С+D показывает, что прямая реакция протекает с образованием меньшего числа молей газа, т.е. с уменьшением давления. Обратная реакция протекает с образованием большего числа молей, т.е. с увеличением давления. При увеличении давления, согласно принципу Ле-Шателье, равновесие смещается в сторону образования меньшего числа молей газообразных веществ, т.е. в направлении прямой реакции.
Задачи к главе 4
|

 раза больше, чем А, т.е. [В]прореаг.= 0, 3× 1, 5=0, 45 моль/л, [В]=С0В-[В]прореаг.=1, 0 – 0, 45=0, 55 моль/л.
раза больше, чем А, т.е. [В]прореаг.= 0, 3× 1, 5=0, 45 моль/л, [В]=С0В-[В]прореаг.=1, 0 – 0, 45=0, 55 моль/л. [С]=0, 15 моль/л.
[С]=0, 15 моль/л.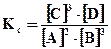 , после подстановки найденных численных значений получим
, после подстановки найденных численных значений получим 0, 912.
0, 912.


