ПРИГОТОВЛЕНИЕ РАСТВОРАЦель работы: Приготовить в мерной колбе объемом 100 мл раствор соляной кислоты заданной концентрации ( Порядок выполнения работы 1. Приготовление раствора. Разбавленный раствор соляной кислоты готовим из концентрированного раствора с известной плотностью (rр-ра). По таблице в справочнике определяем процентную концентрацию исходного раствора кислоты и вычисляем объем этого раствора, необходимый для приготовления 100 мл раствора с заданной моль-эквивалентной концентрацией ( Расчеты проводим по следующим формулам: 1) рассчитываем массу HCl, содержащуюся в 100 см3 раствора с концентрацией
2) рассчитываем массу исходного раствора с процентной концентрацией w(HCl), содержащую рассчитанную массу HCl:
3) рассчитываем объем исходного раствора HCl:
Вычисленный объем раствора исходной соляной кислоты из бюретки переливаем в мерную колбу вместимостью 100 мл, затем в колбу наливаем дистиллированную воду до половины объема, тщательно взбалтываем, после чего прибавляем воду до метки (нижний край мениска должен касаться метки на горле колбы). Закрываем колбу пробкой и вновь тщательно перемешиваем раствор, перевертывая колбу. 2. Проверка концентрации приготовленного раствора. Бюретку заполняем стандартным раствором NaOH с моль-эквивалентной концентрацией 0, 1000 моль/дм3. Пипетку Мора ополаскиваем приготовленным раствором соляной кислоты (с помощью груши набираем раствор HCl выше метки и выливаем его в сливной стакан). Затем отмеряем пипеткой 10 мл приготовленного раствора HCl (нижний край мениска должен касаться метки) и содержимое пипетки переносим в коническую колбу для титрования. Добавляем 1-2 капли фенолфталеина. К полученному раствору из бюретки постепенно добавляем стандартный раствор щелочи, при этом непрерывно взбалтываем содержимое колбы. Добавляем раствор NaOH до появления бледно-розовой окраски. Этот момент соответствует полной нейтрализации кислоты щелочью. Описанный прием в аналитической химии называется титрованием. Титрование повторяем несколько раз до получения трех результатов, отличающихся не более, чем на 0, 1 мл. Результаты титрования записываем в таблицу 5.
Таблица 5 – Объемы раствора NaOH, необходимые для титрования 10 см3 раствора кислоты HCl
3. Рассчитываем моль-эквивалентную концентрацию приготовленного раствора соляной кислоты. Расчет концентрации HCl производим по среднему значению израсходованного объема щелочи, используя формулу:
где V(HCl) – объем кислоты (в данном случае 10 мл); сэкв(NaOH) – моль-эквивалентная концентрация стандартного раствора щелочи (титранта, в моль/дм3), равная 0, 1000 моль/дм3; Vср (NaOH) – средний объем раствора щелочи (в мл), пошедший на титрование. Рассчитываем относительную ошибку, допущенную при приготовлении раствора заданной концентрации
где
Делаем вывод.
|

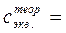 0, 10 – 0, 20 моль/дм3)
0, 10 – 0, 20 моль/дм3)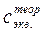 ).
). = …
= …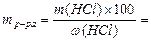 …
…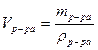 = …
= … (HCl)´ V(HCl) = сэкв(NaOH) ´ Vср(NaOH),
(HCl)´ V(HCl) = сэкв(NaOH) ´ Vср(NaOH), ,
,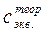 (HCl) – моль-эквивалентная концентрация кислоты, заданная преподавателем;
(HCl) – моль-эквивалентная концентрация кислоты, заданная преподавателем; (HCl) – моль-эквивалентная концентрация кислоты, приготовленная вами и найденная титрованием.
(HCl) – моль-эквивалентная концентрация кислоты, приготовленная вами и найденная титрованием.


