Тема 10. ТермодинамикаУравнения реакций, в которых около символов химических соединений указываются их агрегатные состояния или кристаллическая модификация, а также числовое значение тепловых эффектов, называют термохимическими. В термохимических уравнениях, если это специально не оговорено, указываются значения тепловых эффектов при постоянном давлении Qp, равные изменению энтальпии системы DН. Значение DН приводят обычно в правой части уравнения, отделяя его запятой или точкой с запятой. Приняты следующие сокращенные обозначения агрегатного состояния вещества: г — газообразное, ж — жидкое, к — кристаллическое. Эти символы опускаются, если агрегатное состояние веществ очевидно. Если в результате реакции выделяется теплота, то DН < 0. Стандартные теплоты (энтальпии) образования Пример 1. Реакция горения этана выражается термохимическим уравнением
С2Н6(г) + 3, 5О2 = 2 СО2(г) + 3 Н2О(ж); DН = -1559, 87 кДж.
Вычислите теплоту образования этана, если известны теплоты образования СО2(г) и Н2О(ж).
Решение. Теплотой образования (энтальпией) данного соединения называют тепловой эффект реакции образования 1 моль этого соединения из простых веществ, взятых в их устойчивом состоянии при данных условиях. Так как тепловой эффект с температурой изменяется незначительно, то в дальнейшем индексы опускаются и тепловой эффект обозначается через DН. Следовательно, нужно вычислить тепловой эффект реакции, термохимическое уравнение которой имеет вид 2С (графит) + ЗН2(г) = С2Н6(г); DН =? исходя из следующих данных: а) С2Н6(г) + 3, 5О2(г) = 2СО2(г) + 3Н2О(ж); DН =-1559, 87 кДж; б) С (графит) + О2(г) = СО2(г); DН = -393, 51 кДж; в) H2(r) + 0, 5O2 = Н2О(ж); DН = -285, 84 кДж. На основании закона Гесса с термохимическими уравнениями можно оперировать так же, как и с алгебраическими. Для получения искомого результата следует уравнение (б) умножить на 2, уравнение (в) — на 3, а затем сумму этих уравнений вычислить из уравнения (а): С2Н6 + 372О2 - 2C - 2О2- ЗН2 -3/2О2 = 2СО2 + ЗН2О -2СО2 - ЗН2О DН = -1559, 87 - 2(-393, 51) - 3(-285, 84) = +84, 67 кДж; DН = -1559, 87 + 787, 02 + 857, 52; С2Н6 = 2С + ЗН2; DН = + 84, 67 кДж. Так как теплота образования равна теплоте разложения с обратным знаком, то DН хр = 2 DН СО2 + З Учитывая, что теплоты образования простых веществ условно приняты равными нулю
Пример 2. Реакция горения этилового спирта выражается термохимическим уравнением С2Н5ОН(ж) + 3О2(г) = 2СО2(г) + 3Н2О(ж); DН =? Вычислите тепловой эффект реакции, если известно, что молярная теплота парообразования С2Н5ОH(ж) равна +42, 36 кДж, а теплоты образования С2Н5ОН(г), СО2(г), Н2О(ж). Решение. Для определения DН реакции необходимо знать теплоту образования С2Н5ОН(ж). Последнюю находим из данных: С2Н5ОН(ж) = С2Н5ОН(г); DН = +42, 36 кДж
Вычисляем DН реакции, применяя следствия из закона Гесса: DН хр = 2(-393, 51) + +3(-285, 84) + 277, 67 = -1366, 87 кДж. Пример 3. В каком состоянии энтропия моль вещества больше при одинаковой температуре: в кристаллическом или парообразном? Решение. Энтропия есть мера неупорядоченности состояния вещества. В кристалле частицы (атомы, ионы) расположены упорядоченно и могут находиться лишь в определенных точках пространства, а для газа таких ограничений нет. Объем 1 моль газа гораздо больше объема 1 моль кристаллического вещества; возможность хаотичного движения молекул газа больше. А так как энтропию можно рассматривать как количественную меру хаотичности атомно-молекулярной структуры вещества, то энтропия 1 моль паров вещества больше энтропии 1 моль его кристаллов при одинаковой температуре. Пример 4. Прямая или обратная реакция будет протекать при стандартных условиях в системе СН4(г) + СО2 → 2СО(г) + 2Н2(г) Решение. Вычислим
То, что Пример 5. На основании значений стандартных теплот образования и абсолютных стандартных энтропии веществ вычислите DG0 реакции, протекающей по уравнению СО(г) + Н2О(ж) = СО2(г) + Н2(г) Решение. DG0 = DН0 - TDS0; DН и DS — функции состояния, поэтому
Пример 6. Реакция восстановления Fe2O3 водородом протекает по уравнению Fe2O3(к)+ ЗН2(г) - 2Fe(к) + ЗН2О(г); DН = +96, 61 кДж Возможна ли эта реакция при стандартных условиях, если изменение энтропии DS = 0, 1387 кДж/(моль·К)? При какой температуре начнется восстановление Fe2O3? Решение. Вычисляем DGo реакции: DG = DH - TDS = 96, 61 - 298 · 0, 1387 = +55, 28 кДж. Так как DG > 0, то реакция при стандартных условиях невозможна; наоборот, при этих условиях идет обратная реакция окисления железа (коррозия). Найдем температуру, при которой DG=0
Следовательно, при температуре ≈ 696, 5 К начнется реакция восстановления Fe2O3. Иногда эту температуру называют температурой начала реакции. Пример 7. Вычислите DH0, DS и DG0r реакции, протекающей по уравнению Fe2O3(K) + ЗС = 2Fe + ЗСО Возможна ли реакция восстановления Fe2O3 углеродом при 500 и 1000К? Решени е. DН°р и DS°p находим из соотношений (1) и (2):
Энергию Гиббса при соответствующих температурах находим из соотношения DG 500 = 490, 54—
Так как DG500 > 0, a DG1000 < 0, то восстановление Fe2O3 возможно при 1000 К и невозможно при 500 К.
|

 некоторых веществ приведены в приложении.
некоторых веществ приведены в приложении. ,. = -84, 67 кДж. К тому же результату придем, если для решения задачи применить вывод из закона Гесса:
,. = -84, 67 кДж. К тому же результату придем, если для решения задачи применить вывод из закона Гесса: -
-  -3, 5
-3, 5 

 = 2(-393, 51) + 3(-285, 84) + 1559, 87 = -84, 67.
= 2(-393, 51) + 3(-285, 84) + 1559, 87 = -84, 67. = -235, 31 -42, 36 = -277, 67 кДж.
= -235, 31 -42, 36 = -277, 67 кДж. прямой реакции. Значения
прямой реакции. Значения  есть функция состояния и что
есть функция состояния и что  ;
;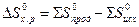
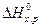 = (-393, 51 + 0) - (-110, 52 - 285, 84) = +2, 85 кДж;
= (-393, 51 + 0) - (-110, 52 - 285, 84) = +2, 85 кДж; = (213, 65 + 130, 59) - (197, 91 + 69, 94) = +76, 39 = 0, 07639 кДж/(моль · К);
= (213, 65 + 130, 59) - (197, 91 + 69, 94) = +76, 39 = 0, 07639 кДж/(моль · К); = +2, 85-298 0, 07639 = -19, 91 кДж.
= +2, 85-298 0, 07639 = -19, 91 кДж.

 = +219, 99 кДж;
= +219, 99 кДж; кДж
кДж


