МЕТОДЫ ОПРЕДЕЛЕНИЯ ФАКТОРОВ НЕСПЕЦИФИЧЕСКОЙ РЕЗИСТЕНТНОСТИ И ОЦЕНКИ ИММУННОГО СТАТУСА МАКРООРГАНИЗМАЦель занятия. Ознакомить студентов с методами тестирования факторов неспецифической резистентности и методами оценки иммунного статуса животного организма. Оборудование и материалы. Культура Е. coli на МПА стерильный МПБ, стерилизатор, шприцы и иглы, спиртово-водный раствор метиленового синего, нормальная и иммунная (противо-эшерихиозная) кроличьи сыворотки, стерильные пастеровские пипетки, 1%-й агар Дифко, ацетоновый порошок М. lysodeicticus (или культура), стерильные чашки Петри, кристаллический лизо-цим, фосфатно-солевой буферный раствор с рН 7, 2...7, 4, эритроциты барана, стерильный физиологический раствор, веронал-мединаловый буферный раствор с рН 7, 3...7, 4, гемолизин, комплемент морской свинки, дистиллированная вода, фотоэлектроколориметр, пластины с результатами радиальной иммунодиффузии по определению иммуноглобулинов разных классов в сыворотке крови, калибровочная кривая для определения содержания иммуноглобулинов разных классов; препараты для подсчета Е-РОК и ЕАС-РОК.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ Методы определения факторов неспецифической резистентности макроорганизма. Защиту макроорганизма от возбудителей инфекционных болезней обеспечивает не только иммунная система, но и механизмы неспецифического порядка: непроницаемость слизистых и кожных покровов, фагоцитоз, бактерицидное действие лизоцима, а также гуморальные факторы: комплемент, пропердин и др. Все эти механизмы (факторы неспецифической резистентности) представляют собой первую линию противоинфекционной защиты, поскольку при первичном контакте с возбудителем иммунный ответ развивается только спустя некоторое время. Количественное определение лизоцима в сыворотке крови. Лизоцим — гидролитический фермент, расщепляющий высокомолекулярные полисахариды бактерий (пептидогликан), находится в тканях, секретах, экскретах (за исключением пота и мочи), действует бактерицидно на многие бактерии. Присутствие и активность лизоцима определяют по его способности вызывать лизис бактерии Micrococcus lysodeicticus. Готовят 1%-й агаровый гель (Дифко) на 1/15 М фосфатно-солевом буферном растворе (ФСБР). В расплавленный агар температурой 60...70°С вносят ацетоновый порошок биомассы М. lysodeicticus из расчета 10 мг на 100 мл геля. Компоненты перемешивают и разливают в чашки Петри (толщина слоя 4 мм). В застывшем агаре делают лунки диаметром 5 мм. Параллельно определяют активность стандартного лизоцима, кристаллизованного из яичного белка. Для этого лизоцим разводят в 1/15 М ФСБР, чтобы получить разведения с концентрацией 0, 5; 1; 3; 5, 10; 20; 40 и 70мг/мл. По 0, 05 мл каждого разведения лизоцима вносят в лунки. Чашки Петри выдерживают 48 ч во влажной камере при 37 °С и измеряют диаметр зоны лизиса М. lysodeicticus вокруг лунок. По полученным данным строят калибровочную кривую, откладывая на осях координат значения концентрации лизоцима и диаметра зоны лизиса. Сыворотку крови разводят в ФСБР в соотношении 1: 5, вносят по 0, 03 мл в лунки и далее поступают, как при определении активности стандартного лизоцима. Измерив диаметр зоны лизиса, по калибровочной кривой вычисляют содержание лизоцима в исследуемой пробе. Количественное определение комплемента в сыворотке крови. Комплемент (С) представляет собой сложную систему главным образом неактивных белков крови. Процесс их активации (по классическому пути) запускается образованием комплекса антиген — антитело (АГ — AT) и происходит в виде цепной реакции: комплекс АГ • АТ+С1+С4+С2+Сз+С5+С6+С7+С8+С9. В процессе активации образуется литический комплекс, который делает мембрану клетки проницаемой, внутрь клетки осмотически по ступает вода, в результате клетка набухает и лопается. Такое разрушение клеток (антигенов) под влиянием антител и комплемента получило название иммунного лизиса. Наиболее эффективно комплемент действует на бактериальные клетки в сочетании с лизоцимом. Кроме того, бактериальные клетки (антигены) после взаимодействия с антителами и комплементом легче поглощаются фагоцитами. Количество комплемента в крови (сыворотке крови) определяют в реакции иммунного лизиса с использованием эритроцитов барана и гемолизина в качестве антител к эритроцитам барана. Приготовление этих компонентов изложено в теме 17. Эритроциты барана, обработанные гомологичными антителами и чувствительные в таком состоянии к литическому действию комплемента, называют гемолитической системой. Количество комплемента измеряют в 50 % гемолитических единицах (СН50). За единицу комплемента принимают такое его количество в объеме 0, 5 мл, которое за 30 мин при 37 °С обусловливает лизис 50 % эритроцитов в 0, 5 мл гемолитической системы (5%-я суспензия эритроцитов барана в веронал-мединаловом буферном растворе с рН 7, 3...7, 4+ гемолизин в тройном титре). Исследуемую сыворотку в возрастающих дозах разливают по пробиркам (например, 0, 02; 0, 03; 0, 04; 0, 05; 0, 08; 0, 1 мл), добавляют ФСБР до 0, 5; мл, вносят во все пробирки по 0, 5 мл стандартизированной гемсистемы. Одновременно ставят контроль на резистентность эритроцитов (0, 5 мл ФСБР + 0, 5 мл гемсистемы). Пробирки встряхивают и выдерживают при 37°С 30 мин, охлаждают при 2...4'°С 10 мин, центрифугируют при 3000 мин-1 15...20 мин, насадочную жидкость колориметрируют и по коэффициенту экстинкции определяют процент гемолиза при помощи заранее построенной калибровочной кривой. Калибровочную кривую строят следующим образом: к 1 мл 5%-й суспензии эритроцитов добавляют 3 мл дистиллированной воды, эритроциты при этом полностью лизируются (100%-й гемолиз). Из полученного лизата путем добавления буферного раствора готовят пробы с 10-, 20-, 30-, 40-, 50-, 60-, 70-, 80-, 90%-м гемолизом. На фотоэлектроколориметре определяют оптическую плотность каждой пробы (кювета шириной 1 мм, синий светофильтр), затем на оси абсцисс откладывают процент гемолиза, а на оси ординат — коэффициент экстинкции. СН5о вычисляют по дозе сыворотки, дающей гемолиз, наиболее близкий к 50 %. Для этого используют специальную формулу (Крога) или, что проще, коэффициенты, рассчитанные по этой формуле (табл. 4). Например, если исследуемая сыворотка в разведении 1: 25 дает 30%-й лизис, то СН50 в 1 мл составит 25 • 0, 844 = 21, 1 ед.
Демонстрация фагоцитоза бактерий. К фагоцитирующим клеткам относят полиморфноядерные лейкоциты крови. Поглощение микробной клетки фагоцитом может не сопровождаться гибелью микроорганизма (незавершенный фагоцитоз) или приводить к внутриклеточному перевариванию захваченных бактерий (завершенный фагоцитоз). Белой мыши внутрибрюшинно сначала вводят 2 мл стерильного МПБ, через два-три часа — 0, 5 мл культуры эшерихий. Спустя 20...40 мин шприцем из брюшной полости отбирают экссудат, делают мазки на предметном стекле, фиксируют спирт-эфиром, окрашивают метиленовым синим (экспозиция 2...3 мин). При микроскопировании можно наблюдать различные стадии фагоцитоза: поглощение, деструкцию (переваривание) клеток (рис. 55). Методы оценки активности фагоцитирующих клеток. Для оценки активности фагоцитов используют следующие показатели: 1) фагоцитарный показатель — процент фагоцитирующих клеток от общего числа учтенных нейтрофильных лейкоцитов;
2) фагоцитарное число — среднее число микробных клеток, поглощенных одним лейкоцитом (характеризует интенсивность фагоцитоза).
Определение фагоцитарного показателя: в чистую стерильную центрифужную пробирку вносят 0, 2 мл 2%-го раствора цитрата натрия, 0, 1 мл крови, взятой у морской свинки или кролика, и 0, 05 мл суспензии убитых нагреванием бактерий S. epidermidis, Е. coli или др. (концентрация 0, 5 • 109 клеток по оптическому стандарту мутности). Компоненты перемешивают и выдерживают при 37...38 " С 30 мин, затем центрифугируют при 2500...3000 мин-1 15...20 мин до образования прозрачного слоя плазмы, слоя эритроцитов и тонкого сероватого среднего слоя лейкоцитов. Осторожно отсасывают плазму, пипеткой берут средний слой, делают три—пять мазков и окрашивают по методу Романовского—Гимзы. Препарат микроскопируют, подсчитывают не менее 100 нейтрофильных лейкоцитов и определяют среди них число (%) фагоцитирующих. Определение фагоцитарного числа: в мазках, которые были приготовлены для определения фагоцитарного показателя, подсчитывают 100 нейтрофильных лейкоцитов и суммарное количество захваченных ими бактериальных клеток, затем определяют фагоцитарное число. Например, 100 лейкоцитов поглотили 500 бактериальных клеток, следовательно, фагоцитарное число равно 500: 100 = 5. Определение опсоно – фагоцитарного индекса. Интенсивность фагоцитоза повышается благодаря антителам — опсонинам, взаимодействующим с микробными клетками. Чтобы определить опсоно-фагоцитарный индекс, сравнивают активность фагоцитов в нормальной и исследуемой (иммунной) сыворотках. Пастеровской пипеткой набирают на высоту капилляра около 2 см сначала суспензию бактериальных клеток (0, 5 • 109/мл), затем лейкоцитов и, наконец, исследуемую сыворотку. На предметном стекле компоненты перемешивают при помощи пипетки, затем вновь набирают в капилляр, конец которого запаивают. Капилляр помещают в термостат при 37 °С на 30 мин. После инкубирования смесь выливают на предметное стекло, готовят мазок и окрашивают его метиленовым синим (1 мл насыщенного спиртового раствора на 30 мл дистиллированной воды). Аналогичным образом готовят препарат с нормальной (контрольной) сывороткой. Оба препарата микроскопируют, просматривают 100 нейтрофильных лейкоцитов, определяют количество фагоцитированных бактерий, рассчитывают фагоцитарное число в каждой сыворотке и затем опсоно-фагоцитарный индекс исследуемой сыворотки. Например, в 100 лейкоцитах нормальной сыворотки фагоцитировано 200 бактерий, следовательно, фагоцитарное число 200: 100 = 2. В 100 лейкоцитах исследуемой иммунной сыворотки захвачено 500 бактерий и фагоцитарное число 500: 100 = 5. Опсоно-фагоцитарный индекс показывает, во сколько раз процесс фагоцитоза в иммунной сыворотке интенсивнее, чем в нормальной. Его вычисляют делением фагоцитарного числа иммунной сыворотки на фагоцитарное число нормальной сыворотки. В приведенном примере опсоно-фагоцитарный индекс составит 5, 0: 2, 0 = 2, 5. Методы оценки иммунного статуса макроорганизма. Работа иммунной системы, как и любой другой системы организма, может нарушаться, что неизбежно повысит восприимчивость животного к инфекционным заболеваниям. Методы оценки Т-системы иммунитета (клеточный иммунитет). Из числа существующих методов оценки Т-иммунитета наиболее известны следующие. Метод «спонтанных розеток» (Е—РОК). Т-Лимфоциты несут на своей поверхности рецепторы, реагирующие с мембранными структурами эритроцитов барана. После сорбции эритроцитов Т-клетки приобретают форму «розетки», что позволяет выявлять их в популяции лимфоцитов. Реакцию проводят в три этапа. Выделение лимфоцитов барана: в центрифужную пробирку наливают 2 мл разделяющего раствора, состоящего из 9%-го водного раствора фиколла и визотраста-370, доведенного до плотности 1, 077 г/мл (соотношение 8: 2). Затем на разделяющий раствор осторожно наслаивают 2...4 мл крови с гепарином (100 МЕ/мл), разведенной средой Игла в соотношении 1: 2...1: 4. Смесь центрифугируют при 600g и температуре 20 °С. Лимфоциты, сконцентрированные в виде беловатого слоя над разделяющим раствором, отсасывают пастеровской пипеткой и отмывают средой Игла (при 600g— 10 мин два раза, 200g — 10 мин один раз). Инкубация: средой Игла концентрацию лимфоцитов доводят до 3 • 106/мл. Готовят суспензию эритроцитов барана, эритроциты отмывают 0, 15 М раствором хлорида натрия (три раза), затем из них готовят 0, 5%-ю суспензию в среде Игла. Далее смешивают по 0, 5 мл суспензии лимфоцитов и эритроцитов, смесь центрифугируют при 200g 5 мин и оставляют при 4 °С на 18 ч. Учет реакции: осторожно покачивая пробирку, ресуспендиру-ют осадок (не перемешивая), каплю суспензии вносят в счетную камеру и исследуют методом фазово-контрастной микроскопии. Просматривают не менее 200 лимфоцитов и подсчитывают те клетки, к поверхности которых прикреплено более трех эритроцитов (рис. 56), — естественные розеткообразующие клетки (Е— РОК). Технология выращивания животных отражается на их физиологическом состоянии и на количестве Т- и В-клеток в частности (табл. 5).
Выявление Т-хелперов и Т-супрессоров. Т-хелперы и Т-супрессоры несут на своей поверхности специфические антигены, которые можно обнаружить при помощи мышиных моноклональных антител (см. тему 20) в реакции непрямой иммунофлуоресценции (см. тему 18). Лимфоциты, связавшие моноклональные антитела, светятся по периферии клеток, что позволяет определить их количество при микроскопическом исследовании. Методы оценки В-системы иммунитета (гуморальный иммунитет). Включают в себя оценку В-лимфоцитов (общее содержание в крови, анализ антигенных детерминант) и вырабатываемых ими антител.
Количественное определение иммуноглобулинов разных классов методом радиальной иммунодиффузии (по Манчини). Количество и соотношение иммуноглобулинов отдельных классов в биологических жидкостях отражают состояние В-системы. Методика постановки реакции изложена согласно Ю. Н. Федорову (1981).
Иммунную сыворотку против антител определенного класса (IgG, IgM, IgA) вносят в расплавленный агаровый гель. После застывания агара антитела в нем равномерно распределены. Внесенный в лунку исследуемый материал (антиген) радиально диффундирует в толщу геля. Поскольку концентрация антител везде одинакова, то в результате реакции антиген — антитело в зоне эквивалентности образуются не полосы преципитации, а кольцо преципитации вокруг лунки с антигеном (рис. 57). Диаметр кольца преципитации прямо пропорционален концентрации антигена в исследуемой жидкости.
В предварительных опытах определяют оптимальное (рабочее) разведение антисывороток к иммуноглобулинам каждого класса. В каждом опыте устанавливают количество иммуноглобулинов в В агаре пробойником вырезают лунки диаметром 2 мм (5 рядов по 7 лунок в каждом). В лунки первого ряда вносят разведения стандартной сыворотки, в остальные — исследуемые пробы по 1 мкл. Пластинку выдерживают во влажной камере 24 ч (IgG, IgA) или 48 ч (IgM).
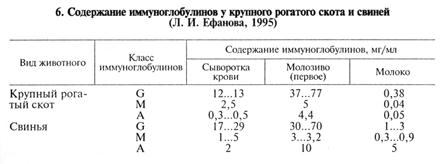
Количество иммуноглобулинов разных классов в биологических жидкостях варьирует в широких пределах (табл. 6).
Все методы определения В-лимфоцитов в крови основаны на выявлении на поверхности В-лимфоцита структур, специфических только для В-клеток: рецепторы к Fc-фрагменту иммуноглобулинов, рецепторы к С3-фракции комплемента, иммуноглобу- линовые рецепторы, а также специфические В-антигены. Метод розеткообразования (ЕАС—РОК): эритроциты барана обрабатывают антителами гемолизина, затем комплементом. Образуется комплекс АГ—AT—С, содержащий компонент комплемента С3. Далее смешивают лимфоциты животного и обработанные эритроциты барана. Эритроциты за счет присутствующих на их поверхности молекул С3 избирательно сорбируются на В-лимфоцитах, образуя «розетки». Другие методы основаны на выявлении рецепторов к Fc-фрагментам иммуноглобулинов и иммуноглобулиновых детерминант на поверхности В-клеток. Рецептор к Fc-фрагменту иммуноглобулинов способен связывать агрегированный γ -глобулин, меченный флуорохромом, что можно в последующем установить при помощи флуоресцентного анализа. Используя меченные флуорохромом антиглобулиновые сыворотки или антисыворотки против иммуноглобулинов отдельных классов, например моноклональные антитела (см. тему 21), можно определить общее содержание В-клеток и дифференцировать клетки, несущие IgG-, IgA-, IgM-детерминанты. ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ 1. Ознакомиться с фагоцитозом методом микроскопии мазков из перитонеального экссудата мышей после введения в брюшную полость культуры эшерихий. 2. Определить опсоно-фагоцитарный индекс иммунной сыворотки против Е. coli. 3. Оценить результаты титрования лизоцима в крови. 4. Ознакомиться с иммунным лизисом эритроцитов, определить содержание комплемента в сыворотке крови морской свинки. 5. Подсчитать количество Е—РОК лимфоцитов в готовых препаратах. 6. Оценить результаты реакции радиальной иммунодиффузии и рассчитать, используя готовую калибровочную кривую, содержание иммуноглобулинов разных классов в сыворотке крови. Контрольные вопросы 1. Из каких стадий состоит процесс фагоцитоза? 2. Что такое фагоцитарное число, фагоцитарный показатель, опсоно-фагоцитарный индекс? 3. Как определяют активность комплемента? 4. Какими методами определяют количество иммуноглобулинов разных классов в биологических жидкостях? 5. Какие методы применяют для оценки В- и Т-систем иммунитета?
Тема 15 СЕРОЛОГИЧЕСКИЕ РЕАКЦИИ: АГГЛЮТИНАЦИИ (РА), НЕПРЯМОЙ ГЕМАГГЛЮТИНАЦИИ (РИГА), КУМБСА (РК). ОБОРУДОВАНИЕ ДЛЯ ПОСТАНОВКИ СЕРОЛОГИЧЕСКИХ РЕАКЦИЙ Цель занятия. Ознакомить студентов с реакциями агглютинации, гемагглютинации и реакцией Кумбса, с техникой их постановки и учета результатов. Оборудование и материалы. Культуры Е. coli различной серо-групповой принадлежности на МПА, О-агглютинирующие диагностические эшерихиозные сыворотки, бруцеллезный роз-бенгал антиген, положительная бруцеллезная сыворотка, планшеты с результатами титрования иммунной сыворотки в РИГА, единый бруцеллезный антиген, мерные пипетки. Серологические реакции рассмотрены последовательно в пяти темах (№ 15... 19).
МЕТОДИЧЕСКИЕ УКАЗАНИЯ Взаимодействие микробного антигена и антител носит строго специфический характер и направлено в животном организме на нейтрализацию возбудителя и его токсинов. Взаимодействие антигена и антител in vitro при определенных условиях сопровождают видимые феномены (агглютинация, преципитация, иммунный лизис), что позволяет использовать АГ—АТ-реакции, получившие название серологических (лат. serum — сыворотка), в практических целях. Биофабрики выпускают антигены и иммунные сыворотки (антитела) известной специфической направленности (диагностические). При помощи таких сывороток в серологических реакциях можно идентифицировать неизвестный микроорганизм или, применяя известный антиген, обнаружить в Организме антитела, синтезированные в ответ на внедрение возбудителя, и таким образом поставить диагноз (серологическая диагностика). Кроме того, серологические реакции можно использовать для оценки интенсивности иммунного ответа после вакцинации или перенесенной инфекционной болезни. Реакции агглютинации, непрямой гемагглютинации и Кумбса основаны на взаимодействии in vitro корпускулярных антигенов с антителами и способности образовавшихся комплексов выпадать в осадок. В качестве корпускулярных антигенов используют бактериальные клетки или растворимые антигены, экстрагированные из микроорганизмов и сорбированные на корпускулах носителей: эритроцитах, частицах латекса и т. д. Антигенные детерминанты корпускулярных антигенов специфически взаимодействуют с гомологичными антителами (специфическая, невидимая фаза реакции), а затем комплексы антиген — антитело образуют крупные, видимые невооруженным глазом конгломераты, которые выпадают в осадок — агглютинат (неспецифическая, видимая фаза реакции). Антигены и антитела взаимодействуют лишь в присутствии электролита (в 0, 8%-м растворе хлорида натрия). Реакция агглютинации (РА). Разработано несколько, вариантов реакции агглютинации, различающихся по методическому исследованию и цели исследования. РА на стекле. 1. Для идентификации микроорганизма на обезжиренное предметное стекло наносят раздельно каплю известной агглютинирующей диагностической сыворотки, например сальмонеллезной, и каплю физиологического раствора (контроль). Затем бактериологической петлей берут бактериальную массу изучаемой культуры из колонии в чашке Петри или с поверхности скошенного МПА в пробирке и суспендируют раздельно в иммунной сыворотке и физиологическом растворе до получения гомогенной взвеси. Результат учитывают через 2...4 мин. Учет результатов: в контрольной пробе изменения должны отсутствовать. При специфическом соответствии культуры бактерий иммунной сыворотке появляются хлопья агглютината (положительный результат), в случае отсутствия феномена агглютинации делают заключениё о том, что исследуемая культура бактерии не соответствует иммунной сыворотке. 2. Обнаружение антител в исследуемой сыворотке крови рассмотрим на примере роз-бенгал пробы, применяемой при серодиагностике бруцеллеза. На предметное стекло наносят 0, 3 мл исследуемой сыворотки крови животного и 0, 03 мл бруцеллезного антигена (окрашенные розовым-бенгальским клетки бруцелл). Компоненты тщательно перемешивают покачиванием стекла и через 4 мин учитывают результат. Учет результатов: при положительной реакции появляются розовые хлопья агглютината. Серологическую реакцию подобного типа относят к качественной, так как с ее помощью можно выявлять антитела к возбудителю в сыворотке крови животного, но невозможно оценить их количественное содержание. Пробирочная РА. 1. Обнаружение антител в сыворотке крови рассмотрим на примере РА для серологической диагностики бруцеллеза крупного рогатого скота. Схема постановки опыта приведена в таблице 7. Общий объем компонентов реакции 1 мл.
Одновременно по аналогичной схеме исследуют заведомо положительную и отрицательную сыворотки (положительный и отрицательный контроли). Учет результатов начинают с контрольных пробирок — не должно быть спонтанной (неспецифической) агглютинации в 6-й пробирке (контроль антигена) и хлопьев осадка в 1-й пробирке (контроль сыворотки). В остальных пробирках наличие и интенсивность агглютинации учитывают визуально и оценивают в крестах: 1) (++++)— полная агглютинация — хорошо выраженный осадок и полное просветление жидкости (агглютинировало 100 % антигена); 2) (+++) — неполная агглютинация с хорошо выраженным осадком и со слабой опалесценцией жидкости (агглютинировало 75% антигена); 3) (++) —частичная агглютинация с небольшим осадком, надосадочная жидкость мутная (агглютинировало 50 % антигена); 4) (+) — очень небольшой осадок, жидкость непрозрачная (агглютинировало 25 % антигена); 5) (—) — отсутствие агглютинации, осадка нет, жидкость мутная. За положительный результат принимают агглютинацию минимум на два креста. Максимальное разведение исследуемой сыворотки крови, обеспечивающее агглютинацию минимум на два креста или более, называют титром сыворотки. Титр сыворотки отражает количественное содержание антител в крови исследуемого животного.
Из приведенного примера (табл. 8) видно, что антиген специфичен, так как отсутствует спонтанная агглютинация с физиологическим раствором и нормальной (отрицательной) сывороткой, и активен — взаимодействует с заведомо положительной сывороткой. Следовательно, можно учитывать результаты РА с исследуемой сывороткой крови. Титр исследуемой сыворотки (титр антител) в данном случае составляет 1: 200. Пробирочную РА используют не только для серодиагностики инфекционных болезней, но также для оценки активности диагностических агглютинирующих сывороток или интенсивности поствакционального иммунологического ответа. Количество антител может служить диагностическим критерием. Под диагностическим титром понимают минимальное количество антител к данному антигену в исследуемой сыворотке, заведомо превышающее количество нормальных антител к используемому в реакции антигену в сыворотке животного того же вида. При диагностическом титре антител и выше животное рассматривают как больное или переболевшее. При некоторых инфекцияхэтот подход не всегда продуктивен, и тогда исследуют «парные сыворотки», т. е. сыворотки, взятые от животного дважды с интервалом три-четыре недели, причем первую пробу необходимо брать не позднее двух-трех суток после появления клинических симптомов болезни. На активный инфекционный процесс указывает существенное повышение титра антител во второй пробе. 2. Для идентификации микроорганизмов используют пробирочную РА, если из-за антигенного родства с различными видами или внутривидовыми сероварами в РА на стекле микроорганизм идентифицировать не удалось. Например, если культура Е. coli дает в РА на стекле положительный результат одновременно с иммунными сыворотками против нескольких О-серогрупп, ее испытывают как антиген с теми же сыворотками уже в пробирочной РА и относят к той О-серогруппе, с сывороткой которой она дает максимальные титры (см. тему 29). Реакция непрямой (пассивной) гемагглютинации (РНГА). Данную реакцию относят к серологической реакции осадочного типа. В ней используют растворимые микробные антигены, сорбированные на эритроцитах как носителях (антигенный диагностикум), или сорбированные на эритроцитах антитела известной иммунной сыворотки (антительный диагностикум). Антигенные диагности-кумы применяют для серологической диагностики, антительные — для обнаружения антигенов в исследуемом материале. Приготовление антигенных диагностикумов. Дефибринированную кровь отмывают ФСБР (рН 7, 2) три раза. Для стабилизации (фиксации) эритроциты обрабатывают формальдегидом, глутаровым или акриловым альдегидом. Наиболее распространена формалинизация эритроцитов: 50%-ю суспензию эритроцитов смешивают с 50%-м раствором формалина в соотношении 1: 1, выдерживают, периодически встряхивая, при 37 º С 2 ч и затем отмывают ФСБР три раза. Эритроциты легко сорбируют на своей поверхности полисахариды, а после обработки танином и белки. Танинизацию проводят, смешивая 2, 5%-ю суспензию эритроцитов и раствор танина (1: 20 ООО) в соотношении 1: 1с последующим выдерживанием при 37 °С в течение 15 мин. Затем эритроциты отмывают ФСБР (три раза) и доводят концентрацию до исходной. Для сенсибилизации 1 мл 2, 5%-й взвеси отмытых таннизированных эритроцитов объединяют с 1 мл антигена и 4 мл ФСБР (рН 6, 4) и выдерживают при 37º С 2 ч. После сенсибилизации эритроциты отмывают три раза и суспендируют в ФСБР (рН 7, 2), который содержит 1 % нормальной кроличьей сыворотки, обеспечивающей стабильность суспензии. Следует отметить, что оптимальное количество антигена для сенсибилизации эритроцитов определяют опытным путем в каждом случае. Обнаружение антител в сыворотке крови. Сыворотку крови перед исследованием инактивируют в водяной бане при 56 °С 30 мин и проверяют на наличие антител к антигенам собственно эритроцитов. Для удаления антиэритроцитарных антител исследуемую сыворотку крови предварительно адсорбируют несенсибилизированными эритроцитами. РНГА на стекле применяют для диагностики пуллороза — тифа птиц (качественная кровекапельная реакция непрямой гемагглютинации — ККРНГА). На сухое обезжиренное стекло глазной пипеткой наносят антиген и свежую кровь (в соотношении 1: 1), взятую из гребня или подкрыльцовой вены птицы, и смешивают, покачивая стекло. Реакцию считают положительной при выпадении в течение двух минут в смеси крови с антигеном хлопьев коричневого цвета. Параллельно ставят контроли с позитивной и негативной сыворотками. Пробирочная РНГА рекомендована для серологической диагностики многих инфекционных болезней. Например, для диагностики сальмонеллезов используют количественную РНГА. Эритроцитарный антиген содержит О-антигены сальмонелл. Исследуемую сыворотку разводят физиологическим раствором в полистироловых планшетах в объеме 0, 5 мл от разведения 1: 100 до 1: 800. Затем в каждую лунку вносят 0, 25 мл диагностикума. Компоненты перемешивают покачиванием планшета и выдерживают в термостате при 37 º С 2...2, 5 ч. Результат РНГА оценивают в крестах (рис. 58): 1) (++++) —все эритроциты агглютинированы и в виде «зонтика» покрывают дно лунки; 2) (+++) — агглютинированы почти все эритроциты. На фоне «зонтика» сформировано малозаметное кольцо из осевших неаг-глютинированных эритроцитов; 3) (++) или (+) — «зонтик» плохо выражен, заметен осадок из неагглютинированных эритроцитов в виде кольца; 4) (—) — эритроциты не склеены и осели на дно в виде узкого колечка с ровными краями либо в виде пунктата или колечка.
Параллельно ставят контроли с заведомо положительной и отрицательной сыворотками. Реакция Кумбса (РК). Данная серологическая реакция также основана на феномене агглютинации. Предназначена для выявления так называемых «неполных» антител, у которых только один активный центр, и по этой причине они могут специфически взаимодействовать с детерминантами антигена, но реакция не завершается формированием макроскопически видимых комплексов антиген — антитело. В частности, РК используют для серодиагностики бруцеллеза животных. Предварительно сыворотки крови исследуют в обычной пробирочной РА. Исходя из результатов РА, для исследования берут пробирки с разведениями сыворотки, где нет агглютинации, но возможно произошло специфическое связывание «неполных» антител с бруцеллезными антигенами. Антиген из этих пробирок отмывают от несвязавшихся (свободных) белков сыворотки крови центрифугированием. К отмытому осадку корпускулярного бруцеллезного антигена добавляют 1 мл разведенной антиглобулиновой сыворотки, содержащей антитела к иммуноглобулинам сыворотки крови животных того вида, который исследуют на бруцеллез. Пробирки со смесью выдерживают при 37 º С 18 ч, затем при комнатной температуре 2...4 ч. Учет результатов: в положительном случае бруцеллезный антиген будет агглютинировать, так как полные антитела антиглобулиновой сыворотки взаимодействуют с «неполными» антителами на поверхности бруцелл и вызывают агглютинацию корпускул антигена. Оборудование для постановки серологических реакций. При массовых серологических исследованиях, определении титра сывороток используют оборудование, с помощью которого можно облегчить процедуру разведения сывороток, внесения компонентов реакции: автоматические пипетки, аппарат Флоринского, микротитратор «Такачи». Аппарат Флоринского: благодаря групповой автоматической пипетке (рис. 59) одновременно разводят 10 сывороток крови или вносят компоненты в 10 стандартных серологических пробирок, размещенных в 100-гнездном штативе (10 х 10).
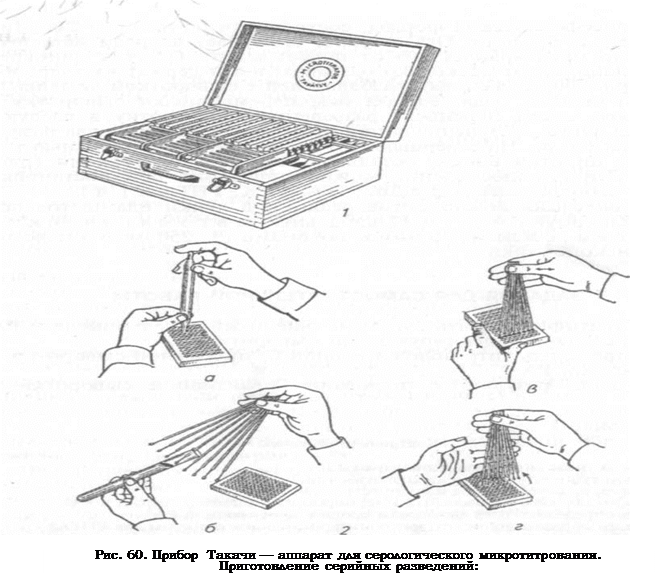
Микротитратор «Такачи» включает в себя полистироловые пластины (129 x 93 мм) с лунками, разбавители — устройства для взятия и разведения сывороток в объеме 0, 025 и 0, 05 мл, стеклянные пипетки-капельницы для разлива предусмотренных условиями опыта объемов растворителя. При помощи стеклянных пипеток, на которые надета капельная насадка в виде пластмассового конуса со стальной трубочкой внутри, разливают по лункам пластины физиологический раствор либо буферный раствор в объеме 0, 025 мл (одна капля) или 0, 05 мл (две капли). Капли определенного объема (0, 025 мл) формируются при условии, что пипетку держат строго вертикально на расстоянии 1 см от пластины (рис. 60, а). Затем при помощи разбавителей берут необходимое количество сыворотки крови. Разбавитель представляет собой тонкие металлические стержни с наконечниками полусферической формы, состоящими из пластин с вертикальными прорезями. Ось стержня выступает впереди наконечника, что предохраняет его от повреждений. Обычно одновременно используют несколько разбавителей и держат их веерообразно (рис. 60, б). Головки разбавителей с сывороткой помещают в лунки первого ряда, вращая ось, перемешивают сыворотку с раствором, затем переносят разведенную сыворотку в следующий ряд лунок, обеспечивая при этом ее разведение в два раза и т.д. (рис. 60, в). На завершающем этапе в лунки с помощью капельной пипетки вносят остальные компоненты реакции (рис. 60, г). Эти приспособления можно применять при постановке многих серологических реакций (РА, РСК, РНГА и т. д.).
Для внесения компонентов реакции в лунки планшетов все чаще используют 4-, 8- и 12-канальные автоматические пипетки с изменяющимися объемами (5...250 мкл) и пластиковые наконечники.
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ 1. Идентифицировать культуры эшерихий и сальмонелл в РА на стекле с О-агглютинирующими сыворотками. 2. Определить титр положительной бруцеллезной сыворотки в пробирочной РА. 3. Учесть результаты титрования позитивной сыворотки в РНГА.
Контрольные вопросы 1.Какие типы антигенов используют в РА? 2.В чем сущность феномена агглютинации? 3.Что такое качественная и количественная РА? 4.Каким образом неизвестный микроорганизм идентифицирует в РА? 5.Как определить титр сыворотки крови в пробирочной РА? 6. Каким образом получают эритроцитарные диагностикумы для РНГА? 7. В чем сущность реакции Кумбса?
Тема 16 РЕАКЦИИ ПРЕЦИПИТАЦИИ (РП): КОЛЬЦЕПРЕЦИПИТАЦИИ (РКП), ДИФФУЗИОННОЙ ПРЕЦИПИТАЦИИ (РДП); ИММУНОЭЛЕКТРОФОРЕЗ Цель занятия. Ознакомить студентов с сущностью и техникой постановки реакций кольцепреципитации, диффузионной преципитации, методом иммуноэлектрофореза. Рассмотреть их практическое использование. Оборудование и материалы. Сибиреязвенная преципитирующая сыворотка, стандартный сибиреязвенный антиген, стерильный физиологический раствор, пипетки Пастера, пробирки Уленгута, 1, 5%-й агаровый гель с мертиолатом (конечное разведение 1: 10 000), стерильные чашки Петри, камера для иммуноэлектрофореза, готовые иммунофореграммы, штампы для РДП.
|






 Строят калибровочную кривую. На оси абсцисс откладывают значения диаметров колец преципитации разведенной стандартной сыворотки, на оси ординат — значения концентраций иммуноглобулинов (% или мг/мл). Измеряют диаметр колец преципитации в пробах и по калибровочной кривой устанавливают концентрацию соответствующего иммуноглобулина.
Строят калибровочную кривую. На оси абсцисс откладывают значения диаметров колец преципитации разведенной стандартной сыворотки, на оси ординат — значения концентраций иммуноглобулинов (% или мг/мл). Измеряют диаметр колец преципитации в пробах и по калибровочной кривой устанавливают концентрацию соответствующего иммуноглобулина.