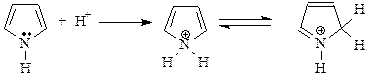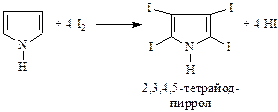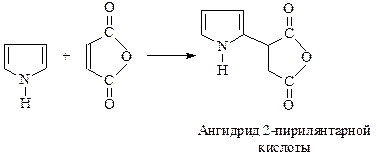Азотсодержащие соединенияОрганических азотистых соединений в нефтях в среднем не более 2—3% и максимально (в высокосмолистых нефтях) до 10%. Большая часть азота концентрируется в тяжелых фракциях и в остаточных продуктах. Азотистые соединения нефти принято делить на основные и нейтральные. Вещества основного характера могут быть отделены от нефти обработкой слабой серной кислотой. Количество азотистых оснований составляет в среднем 30% от суммы всех соединений азота. При перегонке они попадают в дистилляты. Азотистые основания нефти представляют собой гетероциклические соединения с атомом азота в одном из колец, с общим числом колец от одного до трех. В основном они являются гомологами пиридина, хинолина, изохинолина, а также в меньшей степени акридина:
В настоящее время установлено строение многих выделенных из нефти ближайших гомологов азотистых оснований этих классов. Пиридин и его гомологи — жидкости с резким запахом. Пиридин кипит при 115, 26°С, является хорошим растворителем. Хинолин и изохинолин имеют т. кип. ~240°С. Изохинолин плавится при 25°С. Акридин—кристаллическое вещество с т. пл. 107°C. Нейтральные вещества составляют большую часть (до 80%) азотистых соединений нефти и концентрируются в высокомолекулярной части нефтей. Строение и свойства их изучены мало. Можно считать доказанным наличие в некоторых нефтях гомологов пиррола, индола, карбазола:
Азотистые соединения — как основные, так и нейтральные — достаточно В 1934 г. Трейбс открыл наличие в нефтях порфиринов. В дальнейшем они были обнаружены во многих нефтях. Строение их показывает, что они близки к гемину (красящее вещество крови) и хлорофиллу. В составе их молекулы имеется четыре пиррольных кольца. Порфирины весьма склонны к образованию комплексных соединений с металлами. В нефтях они находятся как в свободном состоянии, так и в виде комплексов с ванадием, никелем и железом.
Химические свойства азотсодержащих соединений а) Основные соединения Пиридин можно рассматривать как бензол, в котором группа –СН= замещена атомом азота. И пиридин, и бензол имеют молекулы, представляющие собой практически правильный шестиугольник. Наличие у атома азота неподеленной пары электронов приводит к тому, что пиридин (как и другие азотистые основания – хинолин, изохинолин, акридин) проявляют свойства третичных аминов. Прежде всего это свойства слабых оснований. Константы диссоциации оснований приведены в таблице.
В растворах они взаимодействуют с водой по основному типу:
Концентрации гидроксильных ионов оказывается достаточно для образования гидроксидов целого ряда металлов: Fe3+, Co2+, Sn2+ и других. Соединения легко образуют соли с кислотами, такими как соляная, бромоводородная, серная и другие:
Соли хорошо кристаллизуются и используются для выделения и идентификации соединений азота. Интересно, что соли акридина в водных растворах имеют зеленую флуоресценцию, а при разбавлении вследствие гидролиза флуоресценция переходит в синюю, характерную для свободного акридина. Как третичные амины, азотистые основания реагируют с галогеналкилами, образуя соответствующие соли, которые при нагревании изомеризуются в результате перехода заместителя от атома азота к атому углерода в положение 2 или 4 (но не 3):
При обработке пероксидом водорода или пербензойной кислотой в уксуснокислой среде образуются оксиды азотистых соединений:
Пиридиновое ядро, присутствующее в молекулах всех указанных азотистых оснований, подвергается замещению электрофильными, нуклеофильными, радикальными реагентами. При этом нужно учитывать, что присутствие атома азота обедняет кольцо электронной плотностью вследствие его сильного положительного индукционного эффекта, причем особенно обедняются положения 2, 4, 6. Присутствие алкильных или других донорных заместителей облегчает реакции электрофильного замещения. Галогены при низких температурах присоединяются к пиридину с образованием N-галогенидов, которые при нагревании превращаются в b-галогенпиридины:
Реакция происходит при 300-400°С без катализатора. При нагревании пиридина в течение 24 часов с дымящей серной кислотой до 220-230°С в присутствии сульфата ртути образуется пиридин-3-сульфокислота:
Нитрование пиридина также требует жестких условий. При действии раствора азотной кислоты в 100%-ной серной кислоте при 300°С (в присутствии железного катализатора) образуется 3-нитропиридин с выходом всего 22%:
В более мягких условиях нитрование не происходит. Алкилирование пиридинового кольца по реакции Фриделя-Крафтса также не осуществляется. Помимо индукционного влияния атома азота, причиной затруднений при нитровании и сульфировании является образование нереакционноспособного по отношению к электрофильным реагентам катиона пиридиния, вначале образующегося в кислой среде. Из реакций нуклеофильного замещения можно отметить реакции пиридина с амидом натрия и с сухим КОН при 250-300°С (реакции А.Е. Чичибабина):
В хинолиновых или акридиновых циклах, помимо пиридинового, присутствуют бензольные кольца, более активные в реакциях замещения. Поэтому реакции замещения протекают у этих соединений гораздо легче. В случае хинолина индукционное влияние атома азота приводит к обеднению электронной плотностью положений 2, 4 пиридинового и 5, 7 – бензольного кольца. Поэтому электрофильные агенты атакуют прежде всего положения 8, 6:
Сульфирование хинолина также происходит в жестких условиях: при 220-230°С конц. Н2SO4 превращает хинолин в 8-сульфокислоту, а при 300°С – в 6-сульфокислоту:
При нитровании и сульфировании часто образуются продукты дизамещения: 6, 8-динитрохинолин; 6, 8-хинолиндисульфокислота и другие. При действии нуклеофильных агентов реакция происходит в пиридиновом кольце в a-положение:
В изохинолине электрофильные частицы атакуют положения 5, 7, а нуклеофильные – 1:
Акридин подвергается атакам электрофилов – в положения 1, 3, 7, 9; нуклеофилов – в положение 9, 10. Акридин, однако, очень устойчив химически, не изменяется при нагревании до 280°С с концентрированными НСl или КОН, легко вступает в реакции присоединения:
Общей реакцией азотистых соединений является их способность восстанавливаться водородом:
б) Нейтральные азотистые соединения В этих соединениях присутствует пятичленное кольцо с атомом азота, находящимся в состоянии sp3-гибридизации, имеющего атом водорода. В образовании ароматической электронной системы участвуют как 4 p-электрона двух связей С=С, так и неподеленная пара электронов атома азота, что приводит к формированию единого шестиэлектронного p-облака – ароматической структуры, подобной бензолу. В результате кольцо пиррола становится плоским, простые связи укорачиваются. Строение пиррольного кольца представлено на схе Пиррол является настолько слабой кислотой, что часто рассматривается как нейтральное соединение (Кд= 5, 4´ 10-15). Соли пиррола образуются лишь при взаимодействии с активными восстановителями, например, металлическим калием или реактивом Гриньяра. При сплавлении пиррола с сухим гидроксидом калия также осуществляется замещение водорода и образование пирролкалия:
Пирролкалий (но не сам пиррол!) реагирует с алкилгалогенидами, например, йодистым этилом, с образованием замещенных пирролов:
Основные свойства пиррола, являющегося формально вторичным амином, маскируются быстрой полимеризацией под действием кислот. При этом пиррол присоединяет протон по неподеленной электронной паре и теряет ароматические свойства (в кольце нарушается сопряжение):
Образующийся катион присоединяется к пирролу (в положение 3), вызывая полимеризацию:
Интересной качественной реакцией пиррола является покраснение сосновой лучины, смоченной соляной кислотой, в присутствии паров пиррола. Предполагается, что это происходит вследствие полимеризации пиррола в кислой среде. Пиррол легко вступает в реакции электрофильного замещения, так как атомы углерода более обогащены электронной плотностью, чем в случае бензола или фенола. При этом электронная плотность в положениях 2 и 5 выше, чем в 3 и 4, поэтому замещение происходит преимущественно в положения 2 и 5. К нуклеофильному замещению пиррол не способен. Пиррол легко галогенируется: хлор, бром, раствор йода в КI легко превращают пиррол в тетрагалогенпиррол:
Сульфирование или нитрование концентрированными кислотами приводят к полимеризации пиррола и не используются при получении соответствующих производных. Пиррол легко восстанавливается водородом:
К пирролу присоединяется и малеиновый ангидрид:
Реакции индола и карбазола сходны с реакциями пиррола. Они обладают очень слабой основностью, осмоляются кислотами и окрашивают в вишнево-красный цвет сосновую лучинку, смоченную соляной кислотой. Они образуют металлические производные с металлическими калием или натрием:
При 130°С индол-калий может быть получен сплавлением индола с КОН. При электрофильном замещении заместитель предпочтительно вступает в положение 3 (если оно занято – в положение 2). Восстановление водородом на платиновом катализаторе приводит к образованию 2, 3-дигидроиндола. Для карбазола характерны не только реакции пиррола, но и реакции бензольных колец. Так, восстановление водородом (смесь цинка и соляной кислоты) приводит к образованию 1, 2, 3, 4, 10, 11-гексагидрокарбазола:
реакция Фриделя-Крафтса приводит к 3, 6-производным, например:
нитрование приводит к 3-нитрокарбазолу, галогенирование – к 3- и 3, 6-дигалогенкарбазолам, сульфирование – к 3- и 3, 6-карбазолдисульфо-кислотам.
|



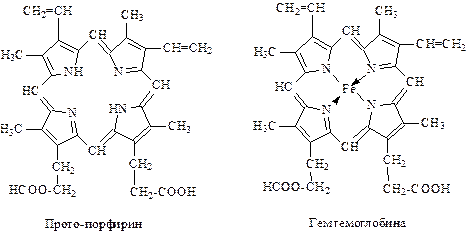

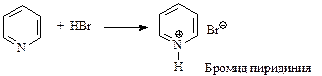 ;
; 









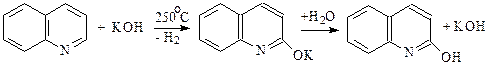





 ме (длина связи указана в ангстремах).
ме (длина связи указана в ангстремах). ;
;