ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ПРОЦЕССЫЦель работы: освоение методики составления уравнений окислительно-восстановительных реакций, установление возможности их протекания, и влияние рН на ход реакции. Все химические реакции можно разделить на два типа. К первому из них относятся реакции, протекающие без изменения степеней окисления атомов реагирующих веществ. Химические реакции второго типа сопровождаются изменением степеней окисления взаимодействующих веществ и называются окислительно-восстановительными:
Степенью окисления (с. о.) называется условный заряд атома в молекуле, вычисленный исходя из предположения, что молекула состоит только из простых ионов. Положительная степень окисления определяется количеством электронов, отданных электронейтральным атомом, отрицательная – количеством электронов, принятых электронейтральным атомом. Степень окисления атома в соединении можно вычислить, зная, что молекула электронейтральна, т. е. алгебраическая сумма степеней окисления атомов в молекуле равна нулю. При этом исходят из правила, что некоторые атомы в соединениях имеют постоянную степень окисления: а) с. о. атомов в простых веществах равна нулю; б) с. о. водорода в соединениях всегда (+ 1), кроме гидридов; в.)с. о. кислорода в соединениях всегда (– 2), кроме пероксидов, надпероксидов, озонидов, г) с. о. фтора в соединениях всегда (– 1); д) с. о. атомов металлов всегда положительна и равна:
е) атомы неметаллов могут иметь как положительную, так и отрицательную степень окисления. Отрицательная с. о. определяется числом электронов, которые может принять электронейтральный атом и равна: (№ гр. – 8); высшая положительная с. о. равна № гр., наиболее устойчивая промежуточная положительная определяется как (№ гр. – 2). Пользуясь этими правилами, можно определить с. о. любого атома в соединении. Например, определим с. о. хлора в следующих соединениях:
Основные положения теории окислительно-восстановительных процессов 1. Окисление-восстановление – это единый процесс. 2. Окислением называется процесс отдачи электронов. Вещество, в состав которого входит элемент, способный отдать электроны, называется восстановителем. В процессе отдачи электронов восстановитель окисляется. 3. Восстановлением называется процесс присоединения электронов. Вещество, в состав которого входит элемент, принимающий электроны, называется окислителем. При присоединении электронов окислитель восстанавливается. 4. Атомы элемента, находящегося в высшей степени окисления, могут проявлять только окислительные свойства, а в низшей степени окисления – только восстановительные свойства. Атом элемента, находящегося в промежуточной степени окисления, может проявлять как окислительные, так и восстановительные свойства. Важнейшие окислители: а) типичные неметаллы – фтор, хлор, кислород и др. Проявляя окислительные свойства, они принимают электроны и превращаются в отрицательные ионы ( б) кислоты и их соли, содержащие атомы металлов и неметаллов в высшей степени окисления – Из кислот наибольшее практическое значение в качестве окислителей имеют азотная и концентрированная серная; в) водород в степени окисления + 1 (в растворах кислот и воде) –
г) ионы, содержащие металлы в высшей степени окисления – Pb 2+, MnO 4–, CrO 42–и др. Важнейшие восстановители: а) нейтральные атомы: металлы и некоторые неметаллы ( Например: б) отрицательно заряженные ионы неметаллов: в) ионы металлов в низшей степени окисления: Вещества, содержащие элементы в промежуточных степенях окисления обладают окислительно-восстановительной двойственностью: могут быть как окислителями, так и восстановителями. Например:
Все окислительно-восстановительные реакции можно разделить на три типа: 1) молекулярные – окислитель и восстановитель входят в состав разных молекул, 2) внутримолекулярные – окислитель и восстановитель входят в состав одной молекулы, 3) диспропорционирования – характерны для веществ, имеющих в своем составе атомы элемента в промежуточной степени окисления. Для составления уравнений окислительно-восстановительных реакций используют метод электронного баланса. Этим методом определяют стехиометрические коэффициенты с помощью электронных уравнений. Для этого: 1. Составляют схему реакции с указанием исходных и образующихся веществ, отмечают элементы, изменяющие степень окисления, находят окислитель и восстановитель. 2. Составляют схемы полуреакций, уравнивая число зарядов в левой и правой части каждой полуреакции. 3. Подбирают коэффициенты для полуреакций с учетом того, что число электронов, отдаваемое восстановителем, должно быть равно числу электронов, принимаемых окислителем. 4. Складывают уравнения полуреакций с учетом коэффициентов. 5. Расставляют коэффициенты в уравнении реакции. Например:
Для количественной характеристики окислительно-восстанови-тельной активности веществ, находящихся в растворах или соприкасающихся с ними, пользуются величинами электродных или окислительно-восстановительных потенциалов. Чем больше алгебраическая величина электродного потенциала, тем активнее данная частица как окислитель, и наоборот. Пользуясь таблицей стандартных окислительно-восстановительных потенциалов, можно предсказать возможность осуществления и направленность окислительно-восстановительных реакций. Процесс может протекать в выбранном направлении при условии, если разность потенциалов имеет положительное значение, а, следовательно, и ЭДС системы величина положительная. Например, перманганат калия Можно ли вместо брома использовать хлор или йод? По таблице стандартных окислительно-восстановительных потенциалов находим электродные потенциалы пар:
Вычисляем ЭДС реакций: ЭДС = Е окис. – E восст а) ЭДС = 1, 08 – (+0, 56) = 0, 52 (В); б) ЭДС = 1, 36 – (+0, 56) = 0, 80 (В); в) ЭДС = 0, 53 – (+0, 56) = – 0, 03 (В). Значит, в качестве окислителя можно использовать хлор, но нельзя йод. При решении вопроса возможного направления протекания окислительно-восстановительных реакций следует помнить: 1. Окислительно-восстановительные реакции протекают в сторону образования менее активных веществ из более активных. 2. Из всех возможных при данных условиях окислительно-восстановительных реакций в первую очередь в большинстве случаев протекает та, ЭДС которой наибольшая. Экспериментальная часть
|

 – реакция обмена;
– реакция обмена; – окислительно-восстановительная реакция.
– окислительно-восстановительная реакция. ;
;



 );
);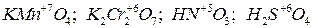 и др.
и др. ;
; и др.). Наиболее сильные восстановители (щелочные и щелочно-земельные металлы) в химических реакциях отдают электроны.
и др.). Наиболее сильные восстановители (щелочные и щелочно-земельные металлы) в химических реакциях отдают электроны. ;
; (например, в соединениях
(например, в соединениях  ) и др.;
) и др.; и др.
и др. ,
,
 .
.
 ,
, восстановитель
восстановитель


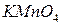 можно получить окислением манганата калия бромом:
можно получить окислением манганата калия бромом:  .
. = 0, 56 В;
= 0, 56 В;
 =1, 36 В;
=1, 36 В;
 = 1, 08 В;
= 1, 08 В;
 = 0, 53 В.
= 0, 53 В.



