Соли кислородсодержащих кислотСоли лантанидов очень похожи по свойствам на соответствующие соли Lа и Y. Для некоторых из них характерны иные цвета, чем для их ионов. Например, Рm(NО3)3 имеет розовую, но РmСl3 – желтую окраску. Сульфаты. Гидратированные сульфаты иттрия, лантана и лантанидов состава Ln2(SO4)3·nH2O получают растворением оксидов, гидроксидов или карбонатов в разбавленной серной кислоте и последующим упариванием растворов. Сульфаты выделяются с различным содержанием кристаллизационной воды: Y – 8; La – 3, 5, 6, 9, 16; Ce – 2, 4, 5, 8, 9, 12; Pr – 5, 6, 8, 12, 15; Nd – 8, 15; Sm, Eu, Gd, Tb, Dy, Ho, Er, Tm, Yb, Lu – 8. Безводные сульфаты получают нагреванием гидратов до 600-650º С, сульфат иттрия – до 400º С, либо действием концентрированной H2SO4 на Ln2O3 при сильном нагревании с последующим удалением избытка кислоты. Сначала образуются кислые сульфаты, которые при нагревании разлагаются: Ln2O3 + 6H2SO4 → 2Ln(HSO4)3 + 3H2O, 2Ln(HSO4)3 → Ln2(SO4)3 + 3SO3 + 3H2O. Дальнейшее нагревание ведет к образованию основных солей и около 900°С состав их отвечает формуле Ln2О3∙ SО3. Выше 1000°С основные соли переходят в оксиды. Безводные сульфаты Ln2(SО4)3 представляют собой гигроскопичные порошки. В холодной воде большинство из них хорошо растворимо. Так, при 25°С растворимость сульфатов приводимых ниже элементов составляет (г / 100 г Н2О): Се Рr Nd Sm Gd Но Еr Yb 5, 1 10, 9 5, 6 1, 5 3, 3 6, 7 15, 2 36, 0. При нагревании растворимость сульфатов, как правило, уменьшается (рис. 3. 6).
Рис. 3. 6. Зависимость растворимости сульфатов лантанидов в воде от температуры
Аналогично ведут себя и октогидраты Ln2(SO4)3·8H2O, растворимость которых в воде с повышением температуры также снижается (табл. 3. 7).
Таблица 3. 7. Растворимость октогидратов средних сульфатов РЗЭ (г / 100 г Н2О)
Y2(SO4)3·6H2O в 100 г воды при 16º С растворяется 4, 47 г, при 95º С – 1, 99 г; La2(SO4)3·9H2O при 25º С – 2, 12 %, при 50º С – 1, 26 %, при 75º С – 0, 981 %, в пересчете на безводную соль. Ионы LnSО4+ довольно устойчивы – их константы диссоциации лежат в пределах от 2∙ 10ˉ 4 до 4∙ 10ˉ 4. Сульфаты РЗЭ склонны к образованию пересыщенных растворов. Этим они похожи на сульфаты кальция и натрия. Безводный сульфат четырехвалентного церия Ce(SO4)2 выделяется в виде темно-желтого кристаллического порошка при взаимодействии СеО2 с горячей концентрированной Н2SО4. Ce(SO4)2 хорошо растворим в воде. Его водные растворы имеют кислую реакцию среды, что является следствием гидролиза. Продукты гидролиза – комплексные гидроксосульфоцериевые кислоты – H[Ce(OH)3SO4], H4[Ce(OH)4(SO4)2] и др. Ce(SO4)2 выше 300º С разлагается. Известен и оранжевый кристаллогидрат Се(SO4)2∙ 4Н2О, который образуется при растворении Ce(OH)4 в концентрированной H2SO4. Оранжевый цвет раствора Се(SО4)2 при добавлении Н2SО4 переходит в красный. Он изоморфен с тетрагидратами сульфатов циркония и тория. Сульфат четырехвалентного церия находит применение в фотографии. Его раствором пользуются в объемном анализе (он более стоек при хранении, чем раствор КМпО4 или K2Сr2О7). Для константы диссоциации иона СеSО42+ было найдено значение 3∙ 10-3. В системе CeO2–SO3–H2O в интервале 25–200º С из растворов с концентрацией H2SO4 0–94% образуется восемь сульфатов церия (IV) различного состава. Основные сульфаты могут быть использованы для отделения Ce от других РЗЭ. Желтый Рr(SО4)2 был получен взаимодействием РrО2 с концентрированной серной кислотой в токе сухого кислорода. Он устойчив при хранении в Н2SO4, с которой образует соединение состава Рr(SO4)2∙ 2Н2SO4, но на воздухе медленно разлагается с изменением окраски на зеленую. Почти нерастворимые в воде (а потому и более устойчивые) сульфаты двухвалентных Sm, Еu и Yb состава LnSO4 могут быть получены катодным восстановлением, а также восстановлением амальгамой щелочных металлов или стронция соответствующих сульфатов Ln2(SО4)3. Это дает возможность сравнительно легко отделять рассматриваемые элементы от других лантанидов. Бесцветный ЕuSО4 (растворимость 7∙ 10ˉ 5 моль/л при 20°С) почти нерастворим и в разбавленных кислотах (не являющихся окислителями). Желто-зеленый YbSО4 и оранжевый SmSО4 растворяются в разбавленных кислотах с выделением водорода. Оксосульфаты образуются при прокаливании безводных сульфатов. Они не растворяются в воде и разбавленной кислоте. Термически устойчивы до 1000º С. Сульфаты иттрия, лантана и лантанидов с сульфатами щелочных металлов и аммония образуют двойные соли состава Мe[Ln(SO4)2]∙ nН2O. Они осаждаются при добавлении сульфатов щелочных металлов и аммония в растворы сульфатов, хлоридов и нитратов иттрия, лантана и лантанидов. Например, Ce(SO4)2 с сульфатами натрия, калия и аммония образует двойные соли – желто-оранжевую К4[Се(SО4)4]∙ 2Н2O и оранжево-красную (NН4)6[Се(SО4)5]∙ 2Н2O. Двойные сульфаты элементов цериевой подгруппы практически не растворяются в насыщенных растворах сульфатов аммония, натрия и калия. Двойные сульфаты элементов иттриевой подгруппы обладают значительной растворимостью. Сульфаты, образованные тербием, занимают промежуточное положение. Различие в растворимости двойных сульфатов используется для предварительного разделения лантанидов на две подгруппы. Растворимость двойных сульфатов K2SO4·Ln2(SO4)3·H2O в насыщенном растворе сульфата калия (в граммах Ln2O3 на 100 мл раствора): Sm – 0, 05, Gd – 0, 77, Y – 4, 685. Состав осадка двойного сульфата зависит от количества добавляемого сульфата щелочного элемента. Доказано существование следующих двойных сульфатов: Ln2(SO4)3·Me2SO4·nH2O, 2Ln2(SO4)3·3Me2SO4·nH2O, Ln2(SO4)3·5Me2SO4. Тиосульфаты Ln2(S2O3)3образуются при взаимодействии тиосульфатов натрия или бария с солями иттрия и РЗЭ. Тиосульфаты хорошо растворимы в воде, поэтому они не выпадают в виде осадков из разбавленных растворов. Из концентрированных растворов постепенно осаждаются в виде порошкообразной массы. Тиосульфаты полностью высаливаются из растворов метиловым или этиловым спиртом. При кристаллизации тиосульфатов первые фракции обогащаются легкими РЗЭ. В последних фракциях кристаллизуются Y и тяжелые РЗЭ в следующем порядке – Y, Tb, Ho, Dy, Er, Yb. Хорошая растворимость тиосульфатов РЗЭ в воде увеличивается по мере увеличения атомного номера элемента. Растворы не гидролизуются даже при кипячении. При подкислении растворов хлороводородной кислотой – разлагаются: Ln2(S2O3)3 → Ln2(SO3)3 + 3S. Повышение температуры до 800-1000º С ведет к разложению тиосульфатов: тиосульфат церия разлагается до CeO2, а остальные – до оксосульфитов Ln2O(SO3)2. Двойные тиосульфаты состава K3[Ln(S2O3)3], Na5[Ln(S2O3)4] и (NH4)3[Ln(S2O3)3] образуются при взаимодействии тиосульфатов элементов цериевой подгруппы с тиосульфатами калия, натрия и аммония. РЗЭ иттриевой подгруппы двойных тиосульфатов не образуют. Селенаты иттрия и лантанидовLn2(SeO4)3·nH2O получают растворением оксидов, гидроксидов и карбонатов в селеновой кислоте и дальнейшим упариванием растворов. Выделяются кристаллогидраты с различным содержанием кристаллизационной воды: Ln2O3 + 3H2SeO4 → Ln2(SeO4)3 + 3H2O. Селенат иттрия Y2(SeO4)3·nH2O, который кристаллизуется при испарении раствора Y2O3 в H2SeO4, хорошо растворяется в воде. Селенат церия Ce(SeO4)2 получают действием селеновой кислоты на гидроксид. Селенаты лантанидов обладают большей растворимостью, чем сульфаты. Селенаты РЗЭ могут образовывать с селенатами щелочных элементов и аммония двойные соли Me[Ln(SeO4)2]·nH2O. Селениты Ln2(SeO3)3·nH2O получают действуя на соли РЗЭ селенитом натрия или селенистой кислотой. Мало растворимы в воде и минеральных кислотах. Ce(SO3)2 получают кипячением раствора нитрата церия в селенистой и азотной кислотах. Не растворяется в воде. Растворим в минеральных кислотах в присутствии H2O2. Нитраты Ln(NO3)3 получают по реакции Ln2O3 + 6N2O4 → 2Ln(NO3)3 + 3N2O3. В виде кристаллогидратов нитраты получают, растворяя оксиды, гидроксиды и карбонаты в азотной кислоте с последующим упариванием растворов Ln2O3 + 6HNO3 → 2Ln(NO3)3 + 3H2O, Ln2(CO3)3 + 6HNO3 → 2Ln(NO3)3 + 3H2O + 3CO2. Выделяются они с различным числом кристаллизационной воды: Y – 4, 6; Ln – 4, 5, 6; Ce – 1, 3, 4, 6; Pr – 2, 4, 6; Nd – 4, 6; Sm – 4, 6; Eu – 6; Gd – 5, 6; Tb – 6; Dy – 5, 6; Er – 5; Tm – 4; Yb – 3, 3, 5, 4, 5; Lu – 4, 5, 5. Лучше кристаллизуются нитраты элементов цериевой подгруппы, труднее – иттриевой. Гексагидраты нитратов лантана и неодима существуют в двух модификациях – α и β. Первые модификации стабильнее при более низких температурах и менее растворимы, чем вторые. У La(NO3)3 · 6H2O α -форма переходит в β -форму при 43º С, у Nd(NO3)3 · 6H2O – при 22º С. Высушивание над концентрированной H2SO4, P2O5 и другими осушителями снижает содержание кристаллизационной воды. Образуются промежуточные кристаллогидраты, вплоть до безводных нитратов (у легких РЗЭ), основных нитратов и оксосолей Ln(OH)2NO3, Ln2O3·LnONO3 (у большинства РЗЭ). При нагревании кристаллогидратов они сравнительно легко разлагаются (причем некоторые предварительно плавятся) с образованием основных солей. При прокаливании они переходят в оксиды. Термическая устойчивость нитратов по ряду Се− Lu в общем понижается. Кристаллогидраты нитратов иттрия и лантаноидов гигроскопичны и легко расплываются на воздухе, теряют воду и переходят в основные соли, мало растворимые в воде. Растворимость нитратов в воде, спирте, азотной кислоте от Се к Gd несколько снижается, а затем от Gd до Lu вновь повышается. Ионы LnNО32+ в растворах сильно диссоциированы (константы диссоциации имеют порядок единицы).. Существует некоторая закономерность в окраске ионов: La3+ – бесцветный, Ce3+ – бесцветный, Pr3+ – желтовато-зеленый, Lu3+ – бесцветный, Yb3+ – бесцветный, Tm3+ – синевато-зеленый, Nd3+ – красно-фиолетовый, Pm3+ – красновато-желтый, Sm3+ – светло-желтый, Er3+ – светло-розовый или бесцветный, Ho3+ – розовый, Dy3+ – желтоватый, Tb3+ – светло-зеленый, Gd3+ – светло-розовый или бесцветный. При разделении смеси РЗЭ применяется метод, основанный на разложении нитратов, особенно для удаления иттрия. Термическая устойчивость в ряду лантан-лютеций понижается. При термическом разложении нитратов до 400º С образуются трудно растворимые основные нитраты от лютеция до эрбия, а нитраты остальных элементов не изменяются. Температура разложения при переходе нейтральной соли в основную или оксид зависит от основности металла. При более высоких температурах разлагаются нитраты более электроположительных РЗЭ. Основные нитраты приблизительного состава Ln[Ln(NO3)(OH)5]·nH2O, 3Y2O3·4N2O5·20H2O получают, действуя раствором щелочи или аммиака на растворы нитратов. При соответствующем температурном режиме и концентрации солей РЗЭ в растворе можно разделить основные нитраты РЗЭ и иттрия. Нитрат Се+4 известен в виде красного основного нитрата Се(ОН)(NО3)3∙ 3Н2O. Его желтый раствор при прибавлении концентрированной НNО3 становится красным. Из такого раствора нитрат церия хорошо экстрагируется эфиром. С нитратами К+, Nа+, NН4+ образуются довольно устойчивые красные комплексные соли типа Мe2[Се(NО3)6], а с нитратами двухвалентных металлов – типа Мe[Се(NО3)6]∙ 8Н2О. Константа диссоциации иона CеNO33+ (0, 06) значительно меньше, чем иона СеNО32+ (2). В смеси с нитратом празеодима (III) был получен и Рr(NО3)4. Нитраты Y и РЗЭ способны образовывать двойные соли с нитратами аммония, щелочных и щелочноземельных элементов. Изучены двойные нитраты типа: Ln(NO3)3 · 2NH4NO3 · 4H2O, 2Ln(NO3)3 · 3Me(NO3)2 · 24H2O (Me ≡ Mg, Ni, Zn и др.). Из комплексных солей для нитратов наиболее характерен тип Мe2I[Ln(NO3)5]∙ 4Н2O или МeII[Ln(NO3)5] ∙ 4Н2O, где МeI и МeII соответственно одно- или двухвалентный металл. Устойчивость таких комплексных солей при переходе от Се к Lu понижается. Двойные нитраты нашли применение при разделении РЗЭ фракционной кристаллизацией. Растворимость двойных нитратов 2Ln(NO3)3 · 3Me(NO3)2 · 24H2O в концентрированной HNO3 увеличивается от La к Gd (в % масс.) La – 6, 38, Pr – 7, 7, Nd – 9, 77, Sm – 24, 55, Gd – 35, 23). Нитриты Ln(NO2)3получаются в виде кристаллических осадков при прибавлении к растворам нитратов или хлоридов РЗЭ растворов нитритов натрия или бария. Нитриты РЗЭ образуют с нитритами щелочных и других металлов двойные соли состава Me3Ln(NO2)6·H2O и тройные Me2MeLn(NO2)6 имеющие ценные свойства, которые могут быть использованы для аналитических и технологических целей при разделении РЗЭ на подгруппы. В отличие от нитрата, перхлорат Се+4 известен и в виде средней соли – Се(СlO4)4. Интересно имеющееся указание на то, что под действием прямого солнечного света на подкисленный хлорной кислотой раствор Се(СlO4)4 + Се(СlO4)3 происходит образование смеси кислорода с водородом, то есть фотохимическое разложение воды на элементы. Фосфаты. Метафосфаты Y и лантанидов Ln(PO3)3 получают, растворяя сульфаты в расплавленной метафосфорной кислоте. Они не растворяются в воде и разбавленных минеральных кислотах. Гипофосфаты Ln2(P2O6)3 образуются при смешении растворов нитратов РЗЭ с гипофосфатом щелочного металла. Растворимость гипофосфатов возрастает при уменьшении ионного радиуса элементов. Ортофосфаты LnPO4. Безводные ортофосфаты получают, сплавляя оксиды с метафосфатом щелочного металла и обрабатывая охлажденный сплав водой. Безводный ортофосфат иттрия встречается в природе в виде минерала ксенотима. Ортофосфаты не растворяются в воде и минеральных кислотах. Гидратированные ортофосфаты образуются при взаимодействии водных растворов солей иттрия и лантанидов с фосфорной кислотой. Кристаллогидраты LnPO4·nH2O хорошо растворяются в разбавленных минеральных кислотах. Гидратированный ортофосфат церия (IV) получают, действуя фосфорной кислотой на слабокислый раствор сульфата или нитрата церия (IV). При нагревании он постепенно обезвоживается: Ce3(PO4)4·nH2O Трудно растворяется в минеральных кислотах. В присутствии H2O2 растворимость Ce3(PO4)4 в минеральных кислотах значительно возрастает за счет его перехода в CePO4: 2Ce3(PO4)4 + 3H2O2 = 6CePO4 + 2H3PO4 + 3O2. Это свойство используется для отделения церия от остальных РЗЭ. Все соли LnPO4·nH2O термически устойчивы. Устойчивость повышается от солей празеодима к солям иттербия. Термическое обезвоживание протекает так же, как у Ce (IV), - ступенчато в две, три, а то и четыре стадии. Полное обезвоживание наступает при 400-600º С. Водородный показатель начала количественного осаждения средних ортофосфатов РЗЭ различен. Так, PrPO4·nH2O осаждается при рН = 1, 5; SmPO4·nH2O – при рН = 1, 7; GdPO4·nH2O и TbPO4·nH2O – при рН = 2, 5. Это можно использовать для разделения указанных элементов. Высокая термостойкость фосфатов обусловила их использование в качестве компонентов защитных покрытий. Гидрапирофосфаты LnHP2O7 образуются при растворении гидроксидов или карбонатов в водном растворе пирофосфорной кислоты. Они нерастворимы в воде, но хорошо растворимы в разбавленных минеральных кислотах. В промышленности РЗЭ отделяют от Th осаждением малорастворимого пирофосфата тория, выпадающего в осадок при рН = 1. Пирофосфаты РЗЭ выделяются из раствора при значениях водородного показателя 2, 3 – 4, 0. Пирофосфаты Ln4(P2O7)3·nH2O образуются при рН = 4 из растворов хлоридов РЗЭ при добавлении раствора пирофосфата аммония. Пирофосфаты неодима и эрбия – розового цвета, празеодима – зеленого, самария – желтого, лантана, церия, гадолиния, диспрозия, лютеция, иттрия – белого. Пирофосфат церия (IV) – CeP2O7·12H2O образуется при действии пирофосфата аммония на растворы нитрата церия (IV) в виде аморфного осадка, хорошо растворимого в кислоте. Значения растворимости пирофосфатов РЗЭ в воде невелики и, в ряде случаев, отличаются незначительно (табл. 3. 8).
Таблица 3. 8. Значения водородного показателя насыщенных растворов и растворимость пирофосфатов некоторых РЗЭ в воде при 25º С
Диметилфосфаты Ln[(CH3)2PO4]3 получают обработкой гидроксидов и других соединений РЗЭ диметилфосфорной кислотой (CH3)2HPO4 Ln2O3 + 6(CH3)2HPO4 = 2 Ln[(CH3)2PO4]3 + 3H2O. Диметилфосфаты различаются по растворимости в воде. Растворимость снижается при увеличении температуры. Так, растворимость диметилфосфатов La, Ce, Nd, Sm при 25º С (в г/100 г H2O) соответственно равна 103, 7; 79, 6; 56, 1; 35, 2.
Таблица 3.8. Растворимость диметилфосфатов некоторых РЗЭ в воде (г/100г) при различных температурах
Карбонаты. Средние карбонаты иттрия и лантанидов Ln2(CO3)3 получают в виде аморфных или кристаллических осадков действием на водные растворы солей разбавленными растворами карбонатов натрия, калия или аммония, взятых в стехиометрическом количестве. При нагревании выпадают смеси средних и основных карбонатов. Можно получить средние карбонаты, насыщая гидроксиды углекислым газом. Кристаллические карбонаты осаждаются в виде гидратов с различным числом молекул воды. Из 0, 02 н. растворов нитратов осаждаются карбонаты: La при рН = 4, 72, Nd – 4, 82, Yb – 5, 51, Y – 5, 62. Это можно использовать для отделения Y. В системах ЭCl3 – Э(NO3)3 – Me2CO3 – H2O (где Ме ≡ K, Na, Li, Cs, Rb, NH4) взаимодействие Y3+ с карбонатами щелочных металлов протекает в несколько стадий – образуется Y2(CO3)3·4H2O; La2(CO3)3·8H2O – в одну стадию. Ln2(СO3)3 почти нерастворимы в воде, причем их относительная растворимость (лантан с ее значением 2, 6∙ 10-4 моль/л при 25°С принят за единицу) имеет минимум на гадолинии: La Се Рr Nd Sm Gd Dу Er Yb 1 0, 81 0, 74 0, 68 0, 62 0, 56 0, 65 0, 81 0, 90. Средние карбонаты при нагревании в воде гидролизуются, переходя в основные карбонаты Ln2(CO3)3 + 2H2O → 2Ln(OH)CO3 + H2CO3. При термической диссоциации карбонатов могут образоваться оксокарбонаты La2(CO3)3 Карбонат церия при нагревании переходит в CeO2: Ce2(CO3)3 Поведение карбонатов при медленном нагревании аналогично поведению сульфатов и нитратов. Сначала они теряют кристаллизационную воду, затем CO2. При дальнейшем нагревании образуют оксиды. Карбонаты удобны для получения оксидов и других соединений РЗЭ. Если к концентрированным растворам карбонатов аммония, калия или натрия прибавлять концентрированный раствор хлорида или нитрата РЗЭ, то образуются двойные карбонаты типа Me2CO3·Ln2(CO3)3·nH2O. Растворимость двойных карбонатов растет в растворе щелочного металла с увеличением порядкового номера РЗЭ; таким образом она выше у элементов иттриевой подгруппы, чем цериевой. Последние практически не растворяются. Растворимость в избытке осадителя возрастает в ряду NH4+ – Na+ – K+. Двойные карбонаты могут быть использованы для разделения РЗЭ на цериевую и иттриевую подгруппы. В избытке щелочного карбоната эти соли почти нерастворимы, а водой гидролитически разлагаются. Есть сведения, что термическая устойчивость карбонатов с увеличением атомного номера лантанида не уменьшается, а возрастает. Интересным соединением четырехвалентного церия является перекисное производное его карбоната. При введении в концентрированный раствор Ка2СО3 соли трехвалентного церия образуется Се2(СО3)3. В соприкосновении с воздухом раствор этой соли постепенно приобретает темно-красную окраску. Реакция протекает, вероятно, по схемам: Се2(СО3)3 + 2Н2О + О2 = Се2(СО3)3(ОН)2 + Н2О2 и Се2(СО3)3(ОН)2 + Н2O2 = Се2(СО3)3О2 + 2Н2О. В присутствии сравнительно слабых восстановителей (например, Аs2О3) пероксид водорода тратится на их окисление и вторая стадия процесса не идет. Результатом в этих условиях является окисление всего Се до четырехвалентного с образованием желтого комплекса K6[Се(СО3)5], после чего реакция прекращается. Более сильные восстановители (например, глюкоза) восстанавливают не только Н2О2, но и церий (до +3). Последний вновь окисляется кислородом воздуха, затем окисляет новую порцию глюкозы и т. д., выполняя в системе роль катализатора. Подобный карбонатам лантанидов своеобразный ход изменения растворимости имеют и их йодаты Ln(IO3)3 (лантан с растворимостью йодата 9, 1∙ 10-4 моль/л при 25°С принят за единицу): La Се Рr Nd Sm Gd Dу Er Yb 1 0, 98 0, 87 0, 30 0, 77 0, 54 0, 65 0, 69 0, 76. Иттрий со значением растворимости 0, 60 близок к Gd и Dу. Хроматы Ln2(CrO4)3·nH2O осаждаются из растворов нитратов или хлоридов РЗЭ раствором хромата калия. Значение рН осаждения понижается с уменьшением радиуса иона лантанида. Так, хромат неодима из раствора нитрата осаждается при рН = 7, хромат самария из раствора хлорида - при рН = 6, 8, хромат иттрия из раствора хлорида – при рН = 6, 78 и т. д. Хроматы РЗЭ кристаллизуются с различным числом молекул воды в зависимости от способа получения. Безводный La2(CrO4)3 получают, сплавляя LaCl3 с K2CrO4 в электрической печи при 600-700º С. Действуя на водный раствор La(NO3)3 или LaCl3, раствором K2CrO4 при 10º С получают декагидрат La2(CrO4)3·10H2O, который легко переходит в гексагидрат La2(CrO4)3·6H2O. Растворяя La2O3 в минимальном количестве H2CrO4, получают октагидрат La2(CrO4)3·8H2O. Хроматы РЗЭ осаждаются в виде аморфных или мелкокристаллических желтых порошков, трудно растворимых в воде. У иттрия и тяжелых лантанидов – Er, Yb образуются основные хроматы, выпадающие в виде малорастворимых осадков La2(OH)CrO4· nLa(OH)3. У иттрия и гольмия n = 3, у эрбия – 2. Выделение хроматов в этом случае связано с явлением лантанидного сжатия и уменьшением основных свойств гидроксидов с увеличением порядкового номера элемента. Хромат церия (IV) Сe(CrO4)2·2H2O получают, растворяя CeO2 в H2CrO4. При 150-180º С удаляется кристаллизационная вода, затем происходит разложение Сe(CrO4)2. Лантаниды проявляют склонность к образованию двойных хроматов с хроматами аммония и калия: 3(NH4)2CrO4·Ln2(CrO4)3·nH2O, 3K2CrO4·Ln2(CrO4)3·nH2O, 4K2CrO4·Ln2(CrO4)3·nH2O и др. Состав двойных хроматов зависит от концентрации хромата щелочного элемента в растворе. Двойные соединения хроматов калия, аммония, лантана и лантанидов могут применяться при разделении смеси РЗЭ или при очистке Y от примесей РЗЭ. Силикаты Ln2O3·SiO2 получают, прокаливая оксалаты РЗЭ с эквивалентным количеством кварцевого песка при 1700º С до плавления Ln2(C2O4)3 + 3SiO2 +3/2O2 = Ln2(SiO3)3 + 6CO2. Из охлаждаемого плава выделяются силикаты, имеющие окраску: неодим - фиолетовую, празеодим – зеленую, европий – розовую. Силикаты не растворяются в воде. Установлено, что все РЗЭ образуют ортосиликаты Ln2O3·SiO2 и пиросиликаты Ln2O3·2SiO2. Ортосиликаты образуют три группы: первая – ортосиликаты La, вторая – ортосиликаты Pr, Nd, Sm, Eu, Gd, Tb, третья – ортосиликаты Dy, Ho, Er, Tm, Yb, Lu. Типичный представитель этих соединений – Y2SiO5. Пиросиликатам Ln2O3·2SiO2 (где Ln – то La до Ho) присущи полиморфные превращения. У пиросиликатов от Eu до Lu полиморфизм не обнаружен. Y2O3·2SiO2 обнаруживает полиморфизм, плавится инконгруэнтно при 1800º С, образуя ортосиликат и жидкость. Температура обратного перехода 1240º С. Молибдаты Ln2(MoO4)3 получают, сплавляя хлориды с молибдатами щелочных металлов или обезвоживая кристаллогидраты молибдатов нагреванием до плавления. Могут быть получены сплавлением Ln2O3 с MoO3 при 850-900º С. Из расплавленного состояния, в зависимости от условий охлаждения и плавки, кристаллизуются в ромбической или тетрагональной модификации. Температуры плавления молибдатов изменяются от 973º С у Ce до 1347º С у Y. Молибдаты состава Ln2(MoO4)3·nH2O образуются при действии раствора молибдата натрия на растворы хлоридов РЗЭ. Молибдаты РЗЭ с молибдатами других металлов образуют двойные соли. Получаются кристаллизацией из расплава, содержащего оксиды РЗЭ, молибдена и щелочного элемента. Кристаллизацией из расплава, содержащего средний молибдат РЗЭ и молибдат щелочного элемента, образуются двойные молибдаты состава MeLn(MoO4)2, Me5Ln(MoO4)4 и др. (где Me – Li, Na, K, Rb, Cs). Двойные молибдаты могут быть получены из растворов. В системе Ln(NO3)3 – Na2MoO4 – H2O образуются двойные молибдаты состава MeLn(MoO4)2·nH2O. Они могут быть использованы в качестве компонентов стекол оптических квантовых генераторов. Особый интерес представляет молибдат гадолиния, кристалл которого при приложении слабого внешнего воздействия (легкого давления или напряжения в 100 В) способен мгновенно переходить от одной устойчивой внутренней структуры к другой, тоже устойчивой. Переход этот обратим, т. е. при обратной направленности прилагаемого воздействия мгновенно восстанавливается первоначальная структура. Уникальное свойство «кристаллоэластичности» открывает широкие возможности практического использования молибдата гадолиния (при конструировании некоторых оптических установок, вычислительных машин и т. д.). Вольфраматы Ln2(WO4)3·nH2O получают из растворов при взаимодействии вольфраматов натрия с нитратами иттрия и лантанидов. Безводные вольфраматы Ln2(WO4)3 получают спеканием оксидов Ln2O3 и WO3 при 1000º С. Вольфраматы РЗЭ нерастворимы в воде, спирте и ацетоне. Разбавленные минеральные кислоты и растворы щелочей при комнатной температуре действуют на вольфраматы медленно. При 80-120º С кислоты и щелочи растворяют их нацело. Вольфраматы не разлагаются до температур плавления. Они все изоструктурны и имеют моноклинную решетку. При взаимодействии Ln2O3 и WO3, кроме Ln2(WO4)3 образуются Ln2WO6, Ln6WO12 и др. Подобно молибдатам, вольфраматы образуют двойные соли состава Me[Ln(WO4)2] (где Me – Na, K, Rb, Cs).
|


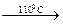 Ce3(PO4)4·11H2O
Ce3(PO4)4·11H2O 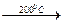 Ce3(PO4)4·5H2O
Ce3(PO4)4·5H2O  Ce3(PO4)4.
Ce3(PO4)4.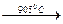 La2O3.
La2O3. Ce2O(CO3)2
Ce2O(CO3)2  Ce2O2CO3
Ce2O2CO3 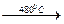 Ce4O7CO3
Ce4O7CO3 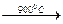 CeO2.
CeO2.


