ЗАНЯТТЯ №4Лабораторна робота №1. Тема: Розв’язування задач на основі законів хімії. Актуальність теми: Знання основ атомно-молекулярного вчення, основних законів хімії і уміння записувати хімічні формули і хімічні реакції складають основу для вивчення хімії. Навчальні цілі: Знати: основні поняття і положення атомно-молекулярної теорії, властивості речовин; хімічні формули, їх типи; закони постійності складу, збереження маси, поняття еквівалента. Уміти: складати хімічні формули, записувати рівняння хімічних реакцій, визначати еквіваленти простих і складних речовин, визначати молекулярну масу, молярну масу і кількість речовини. Самостійна позааудиторна робота ! Написати в робочому зошиті: 1. Знайти відносну атомну або молекулярну масу речовин: Ca, CO2, CuSO4, (CH3COO)2Са. 2. Яка кількість речовини міститься в: а) в озоні O3 об’ємом 2 л, б) в алюміній оксиді Al2O3 масою 102 г? 3. Визначити, який з оксидів містить найбільшу масову частку Оксигену: SiO2; PbO2 чи MnO2? 4. Яку масу кухонної солі (NaCl) можна одержати з 5 г натрію. 5. Знайти масову частку кальцію у сполуці кальцій карбонат (СаСO3). 6. Який об'єм водню необхідний для отримання 35 м3 сірководню (H2S)? 6 Дати відповіді на тести в робочому зошиті: 1. Який елемент має відносну атомну масу 40 а.о.м? а) Кальцій; б) Карбон; в) Алюміній; г) Цинк. 2. Яка відносна молекулярна маса Са(НСО3)2? а) 56 а.о.м.; б) 110 г/моль; в) 96; г) 162. 3. 0, 5 л газу азоту мають масу: а) 7 г; б) 0, 56 г; в) 0, 625 г; г) 0, 28 г. 4. 1, 88∙ 1023 атомів Оксигену мають масу: а) 1, 6 г; б) 3, 2 г; в) 10 г; г) 32 г. Контрольні питання: 1. Що таке атом? 2. Що таке молекула? 3. Що таке хімічний елемент? 4. Що таке хімічна реакція? 5. Що стверджує закон збереження маси? 6. Що стверджує закон сталості складу? 7. Що стверджує закон Авогадро? 8. Що таке стала Авогадро? Яке її цифрове значення? 9. Що таке кількість речовини ν? 10. Що таке моль? Яку кількість частинок містить 1 моль будь-якої речовини? 11. Яке значення молярного об'єму газів за н.у.?
Самостійна робота на занятті ! Написати в робочому зошиті: 1. Знайти відносну атомну або молекулярну масу речовин: Fe(OH)3, C6H5COOH, Na, (NH4)2SO4. 2. Для реакції потрібно 0, 35 моль хлориду кальцію (CaCl2). Яку масу має ця порція речовини? 3. Який об'єм займає 10 г метану (СH4)? 4. Заповнити таблицю:
5. 5 г кальцію карбонату (СаСО3) термічно розклали. Який об'єм вуглекислого газу (н.у.) виділився при цьому? 6. Визначити, який з оксидів містить найбільшу масову частку Оксигену: CrO3 чи Fe2O3? 7. Балон містить 2 кг стиснутого кисню. Який об'єм займе така маса газу за н.у.? 8*.У крові міститься приблизно 15% гемоглобіну. Яка маса гемоглобіну в організмі людини, якщо маса крові 5 кг?
Розділ 2. ПЕРІОДИЧНИЙ ЗАКОН І ПЕРІОДИЧНА СИСТЕМА ЕЛЕМЕНТІВ. БУДОВА РЕЧОВИНИ.
План §2.1. Періодичний закон і система елементів Д.І.Менделєєва. §2.2. Зміна властивостей елементів у періодичній системі Д.І.Менделєєва. §2.3. Будова атома. Ядро. Ізотопи. §2.4. Будова електронних оболонок атомів. §2.5. Квантові числа електронів. §2.6. Електронні формули елементів. §2.7. Залежність властивостей елементів від періодичної зміни електронних структур атомів. §2.1. Періодичний закон і система елементів Д.І. Менделєєва Періодичний закон відкрив Дмитро Іванович Менделєєв і опублікував 1 березня 1869 року. Він сформулював його таким чином: • Властивості хімічних елементів і їх сполук знаходяться в періодичній залежності від атомних мас елементів. Сучасне формулювання з'явилося в 1911 році після відкриття складної будови атомів елементів. ПЕРІОДИЧНИЙ ЗАКОН формулюється так: • ВЛАСТИВОСТІ ХІМІЧНИХ ЕЛЕМЕНТІВ І ЇХ СПОЛУК ЗНАХОДЯТЬСЯ В ПЕРІОДИЧНІЙ ЗАЛЕЖНОСТІ ВІД ЗАРЯДУ ЯДРА І ЕЛЕКТРОННОЇ КОНФІГУРАЦІЇ АТОМІВ ЕЛЕМЕНТІВ. Періодична система елементів – це графічне зображення закону. В основу системи Д.І Менделєєв поклав три принципи: 1. Принцип ЗРОСТАННЯ. Елементи розташовані в періодичній системі в порядку зростання їх атомних мас і зарядів ядер атомів. 2. Принцип ПЕРІОДИЧНОСТІ. Властивості елементів змінюються, а зміни повторюються періодично (від металів через неметали до інертних газів). 3. Принцип ПОШИРЕННЯ. Періодичність зміни властивостей елементів поширюється на їх сполуки. Наприклад, властивості оксидів і гідроксидів елементів в кожному періоді змінюються від основних – через амфотерні – до кислотних. Структура періодичної системи Д.І.Менделєєва Система включає 118 елементів. Всі елементи в періодичній системі мають атомний номер. Кожний елемент має постійне місце (крім Гідрогену) і займає комірку в Періодичній системі.
Періодична система має 7 періодів та 8 груп. ПЕРІОД – це горизонтальний ряд елементів, в якому властивості змінюються від лужного металу через неметали до інертного газу. Кількість елементів в періодах різна. Перший період складається з 2-х елементів. Це супермалий період. У другому і третьому – по 8 елементів. Це малі періоди. У четвертому і п'ятому періодах, по 18 елементів. Це великі періоди У шостому і сьомому - по 32 елементи Це супервеликі періоди. Сьомий період незакінчений. Елементи малих періодів (1, 2, 3) називаються типовими. Як же змінюються властивості елементів одного періоду? У лівій частині періодів елементи проявляють яскраво виражені відновні властивості. Більшість з цих елементів є металами (Li, Na, Mg, Ca). У правій частині зібрані типові неметали, що володіють окисними властивостями (О, F, Cl). У середині періодів розташовуються елементи, що володіють як відновними, так і окисними властивостями – залежно від того, з яким елементом вони реагують. Наприклад, якщо Сульфур (S) реагує з сильним окисником (Оксигеном), то проявляє відновні властивості:
А при взаємодії з сильним відновником (наприклад, із залізом) Сульфур є окисником:
Всі періоди підкоряються важливій загальній закономірності: Кожний період Періодичної таблиці починається активним металом і закінчується інертним газом. Хімічні властивості типових елементів швидко змінюються в межах періоду. У (малих періодах) типових елементів при зміні заряду ядра атома на одиницю до зовнішнього енергетичного рівня додається один електрон. Великі періоди (4, 5, 6, 7) містять елементи підгруп В. У елементів підгруп В не відбувається зміни зовнішнього шару зі зміною заряду ядра, тому хімічні властивості не змінюються. У великих періодах хімічні властивості елементів змінюються повільно. Періодична система містить 8 груп. ГРУПА – це вертикальний стовпчик елементів, які мають однаковий максимальний ступінь окиснення і валентність, що дорівнюють номеру групи, а також однакову кількість валентних електронів ( виняток елементи 1В, 8 груп ). Для елементів однієї групи характерна однакова загальна формула вищого оксиду і гідроксиду.
Таблиця 2.1 Загальні формули вищого оксиду і гідроксиду елементів.
Номер групи співпадає з числом валентних електронів, які можуть брати участь в утворенні хімічних зв'язків. Кожна група ділиться на дві ПІДГРУПИ: А – головну і В – побічну. В головну підгрупу входять s- і p-елементи, в побічну - d-елементи. Елементи побічних підгруп (d-елементи) називають ПЕРЕХІДНИМИ елементами або перехідними металами (всі d-елементи - метали). ПІДГРУПА – це вертикальний стовпчик елементів, які мають схожі хімічні властивості і однакову електронну конфігурацію зовнішнього електронного шару. У підгрупах А розташовані метали, неметали і інертні гази. Всі елементи підгруп В – це метали. Деякі елементи об'єднуються в сімейства. СІМЕЙСТВО – це сукупність елементів; з однаковими хімічними властивостями. Є такі сімейства: лужні метали (1А група), лужноземельні метали ( 2А група ), халькогени (6А група), галогени (7А група), інертні гази (8А група), лантаноїди і актиноїди. Таблиця 2.2. Групові назви елементів.
ЗНАЧЕННЯ ПЕРІОДИЧНОГО ЗАКОНУ І СИСТЕМИ ЕЛЕМЕНТІВ ПЕРІОДИЧНИЙ ЗАКОН – це загальний закон природи. В природі все змінюється періодично (наприклад, пори року, рух землі, сонця, місяця і зірок, періодичні життєві цикли рослин, тварин і людини). Хімічні властивості елементів також змінюються періодично. ПЕРІОДИЧНА СИСТЕМА – це наукова класифікація елементів. Вона допомагає правильно характеризувати властивості елементів і їх сполук, вивчати будову атомів елементів, синтезувати нові речовини. Кожне нове відкриття в хімії підтверджує, що періодичний закон і періодична система елементів Д.І.Менделєєва мають велике наукове значення. §2.2. Зміна властивостей елементів у періодичній системі Д.І.Менделєєва Хімічні властивості елементів тісно пов'язані з електронною будовою атомів і з характером заповнення електронних рівнів. СУТЬ ПЕРІОДИЧНОГО ЗАКОНУ: Ø хімічні властивості елементів змінюються внаслідок зміни в їх атомах заряду ядер і електронної конфігурації; Ø зміни періодично повторюються, оскільки періодично повторюється конфігурація зовнішнього електронного шару атома. Між положенням елементу в періодичній системі, розподілом електронів в його атомі і його хімічними властивостями є зв'язок. Властивості атомів елементів, що постійно зростають в періодичній системі – це атомна маса і заряд ядра атома елементу. Властивості атомів елементів, що періодично повторюються: 1) Металічні властивості елементів зменшуються в періодах зліва направо (®) і збільшуються в групах зверху вниз (¯). Найактивніший метал – Францій (Fr). 2) Неметалічні властивості збільшуються в періодах зліва направо (®) і зменшуються в групах зверху вниз (¯). Найактивніший неметал – Флуор (F2). 3) Радіуси атомів в періодах зліва направо зменшуються (®), в групах зверху вниз (¯) збільшуються. Наприклад: радіус атома літію (Li) більший, ніж радіус атома фтору (F), а радіус атома францію (Fr) більший за радіус атома Літію (Li). 4) Відновні властивості характеризують здатність атомів віддавати електрони іншим атомам в хімічних реакціях. Вони в періодах зменшуються зліва направо (®), а в групах збільшуються зверху вниз (¯). Найактивніший ВІДНОВНИК – францiй (Fr). 5) Окисні властивості характеризують здатність атомів елементів приймати електрони. Вони в періодах збільшуються зліва направо (®). В групах зменшуються зверху вниз (¯ ). Найсильніший ОКИСНИК – флуор (F). 6) Електронегативність (ЕН) – це здатність атомів елементів притягувати до себе загальну пару електронів ковалентного зв'язку від атомів інших елементів в сполуках. Електронегативність в періодах збільшується зліва направо, в групах зменшується зверху вниз. Найбільш електронегативний елемент – це фтор. Відносна ЕН флуору дорівнює 4. ЕН знижується у ряді: F > O > N ≈ Cl > Br > I ≈ S ≈ C > P > H > Si > Al > Ca > K Розглянемо основні закономірності зміни властивостей елементів В ПЕРІОДАХ:
Не змінюється: кількість електронних рівнів (орбіталей). У ГОЛОВНИХ ПІДГРУПАХ (підгрупах А):
§2.3. Будова атома. Ядро. Ізотопи Атом складається з ядра та електронної " хмари", що оточує його. Електрони, що знаходяться в електронній хмарі, несуть негативний електричний заряд. Протони, що входять до складу ядра, несуть позитивний заряд. Окрім протонів, до складу ядра більшості атомів входять нейтрони, які не несуть ніякого заряду. Маса нейтрона практично не відрізняється від маси протона.
У атомі число протонів в ядрі дорівнює числу електронів в електронній хмарі, тому атом в цілому – нейтральна частинка, яка немає заряду. Атом може ВІДДАТИ один або кілька електронів або навпаки – ЗАБРАТИ чужі електрони. При цьому він набуває негативний (‾) або позитивний (+) заряд. Атом, який має позитивний або негативний заряд називається ЙОНОМ. Електрони, протони і нейтрони є головними " будівельними деталями" атомів і називаються субатомними частинками. Їх заряди і маси в кг і в спеціальних “ атомних” одиницях маси (а.о.м.) наведені в таблиці 2.3.
Таблиця 2.3. Субатомні частинки.
Частинки протон та нейтрон, що входять до складу ядра атома, називають нуклідами. З таблиці 2.3 видно, що маси нуклідів, виражені в кілограмах, дуже малі. Тому їх зручніше наводити в атомних одиницях маси (скорочено - а.о.м.). За атомну одиницю маси прийнято 1/12 частину маси атома вуглецю, в ядрі якого міститься 6 протонів і 6 нейтронів.
Схематичне зображення такого " еталонного" атома вуглецю наведено на мал. 2.2 (б).
Мал. 2.2. Атоми складаються з позитивно зарядженого ядра і електронної хмари. а) ядро атому Гідрогену: 1 протон + 1 електрон. б) атома Карбону 6 протонів + 6 нейтронів, а в електронній хмарі - 6 електронів. в) Існує також ізотопний Карбон – в ядрі 6 протонів + 7 нейтронів. На мал. 2.2 показано атоми двох різних елементів: Гідрогену і Карбону. Що ж таке хімічні елементи і чим вони відрізняються один від одного? ХІМІЧНИЙ ЕЛЕМЕНТ – сукупність атомів з однаковим зарядом ядра. Гідроген і Карбон відрізняються числом протонів в ядрі і числом електронів в електронній оболонці. Число протонів в ядрі атома називають зарядом ядра атома (Z). Число протонів в ядрі співпадає з порядковим номером атома в Періодичній таблиці Д.І.Менделєєва. Заряд ядра (число протонів) співпадає з числом електронів в атомі. Коли атоми вступають в хімічні реакції, то відбувається взаємодія між їх електронними оболонками, а не ядрами. Число електронів визначає здатність атома утворювати зв'язки з іншими атомами, тобто його хімічні властивості. Тому атоми з однаковим зарядом ядра (і однаковим числом електронів!) поводяться в хімічному відношенні практично однаково і розглядаються як атоми одного хімічного елементу. Сучасна МОДЕЛЬ АТОМА стверджує: Ø Атоми елементів складаються з позитивно зарядженого ядра і електронів, що рухаються навколо нього. Ø Ядро займає дуже малий об'єм атома. Ø Маса атома зосереджена в його ядрі. Ø Ядро складається з елементарних частинок (нуклонів): протонів і нейтронів. Протон ( Кількість протонів в ядрі визначає заряд ядра (Z) і дорівнює порядковому номеру елементу в Періодичній системі
þ ПОРЯДКОВИЙ НОМЕР ЕЛЕМЕНТУ = ЗАРЯДУ ЯДРА АТОМА. Ø Сума кількості протонів (Z) і нейтронів (N) в ядрі дорівнює атомній масі (масовому числу) (А).
 , N = А – Z. Наприклад: , N = А – Z. Наприклад: 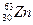 : Z = 30, N = 65 – 30 = 35 : Z = 30, N = 65 – 30 = 35
Ø Число нейтронів в ядрі атомів одного елементу може відрізнятися. ІЗОТОПИ – це атоми одного елементу, які мають однаковий заряд ядра, але різну масу, тобто однакову кількість протонів, але різну кількість нейтронів. Всі елементи мають ізотопи. Наприклад: Один і той же елемент може існувати у вигляді двох або декількох ізотопів. Ізотопи відрізняються один від одного тільки числом нейтронів в ядрі (числом N). Хімічні властивості всіх ізотопів одного елементу однакові. Виняток – ізотопи водню мають різні властивості, тому різні назви і символи: Наприклад, ізотопи водню утворюють три види води: нормальну (Н2О), важку (D2О), надважку (Т2О). Ці речовини мають різні властивості. Ізотопи розділяють на стабільні і радіоактивні. Радіоактивні ізотопи елементів (радіонукліди) використовують в медицині і називають «мічені атоми». За допомогою «мічених атомів» вивчають механізми дії нових ліків, будову і функції органів і тканин, механізми складних біохімічних процесів. þ Атомна маса елементу в періодичній таблиці дорівнює середньому значенню мас всіх природних ізотопів цього елементу.
|



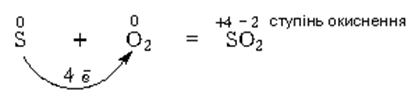

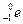 )
)



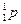 ) – це позитивно заряджена частинка масою 1 а.о.м. Нейтрон (
) – це позитивно заряджена частинка масою 1 а.о.м. Нейтрон (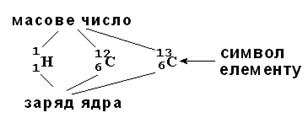
 і
і  ;
;  і
і  ;
; 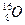 ,
,  і
і 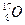 .
. – протій,
– протій,  – дейтерій,
– дейтерій,  – тритій.
– тритій.


