Будова електронних оболонок атомовЕлектронна хмара, що оточує ядро має складну будову. Електрони можуть знаходитися всередині електронної хмари тільки в певних областях, які називають ЕНЕРГЕТИЧНИМИ (або електронними) РІВНЯМИ, ПІДРІВНЯМИ і ОРБІТАЛЯМИ. Якщо електронну хмару атома порівняти з містом, де “живуть” всі електрони даного атома, то рівень можна порівняти з вулицею, підрівень - з будинком, а орбіталь - з квартирою для електронів. Кожний електрон в атомі має свою “адресу”, яка записується набором чотирьох квантових чисел, про які буде детально розказано в параграфі §2.5. Отже, електронна хмара будь-якого атома складається з багатьох електронних рівнів. Електрон має подвійну (корпускулярно-хвильову) природу. Завдяки хвильовим властивостям електрони в атомі можуть мати тільки чітко визначені значення енергії, які залежать від відстані до ядра. Електрони, що мають близькі значення енергії утворюють енергетичний рівень. Він містить певне число електронів – максимально 2n2 (n – номер енергетичного рівня). Енергетичні рівні підрозділяються на s-, p-, d- і f- підрівні; їх число дорівнює номеру рівня. В хімічних реакціях ядра атомів залишаються без змін, змінюється лише будова електронних рівнів внаслідок перерозподілу електронів між атомами. Здатність атома віддавати або приєднувати електрони визначає його хімічні властивості. Електрони “поселяються” ближче до ядра (в цьому випадку їх енергія менша), тому з багатьох енергетичних рівнів атома не всі заселені електронами. Рівні нумерують числами 1, 2, 3... n, починаючи з найнижчого, тобто найближчого до ядра рівня, як показано на мал. 2.3.
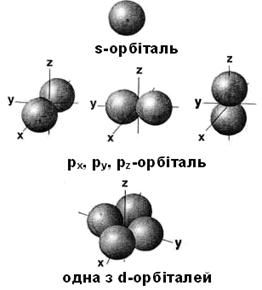
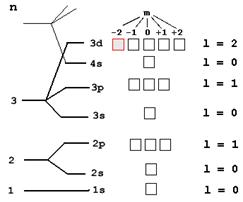
Чим далі від ядра знаходиться рівень, тим складнішу будову він має. Найближчий до ядра рівень № 1 (n = 1) – найпростіший, він має тільки один 1s-підрівень. Рівень № 2 (n = 2) складається вже з двох підрівнів. Вони відрізняються за енергією електронів, що знаходяться на них, і називаються: 2s-підрівень та 2p-підрівень. Третій рівень (n = 3), має вже три підрівні: 3s-, 3p- і 3d. На четвертому рівні (n = 4) до них додається ще і 4f-підрівень (мал. 2.3). Підрівні, у свою чергу, складаються з орбіталей. На мал. 2.3 орбіталі позначені квадратиками. Кожна орбіталь - це ніби “квартира” (в “будинку”- підрівні) для одного або двох електронів. Так, наприклад, s-підрівень – це “будинок” з однієї “квартири” (містить тільки одну s-орбіталь). На p-підрівні містяться три p-орбіталі, на d-підрівні – п′ ять d-орбіталей, на f-підрівні – сім f-орбіталей. АТОМНА ОРБІТАЛЬ це простір навколо ядра атома в якому знаходження електрона є найбільш ймовірним. Внаслідок дуже швидкого руху усередині орбіталі електрон займає її повністю і виглядає як хмара певної форми (куляста або витягнута, схожа на гантель) - залежно від виду орбіталі (мал. 2.4).
Існують орбіталі принаймні 4-х різних видів: s-орбіталі (сферичної форми), p-орбіталі (схожі на об'ємні вісімки), а також d-орбіталі (мал. 2.4) і f-орбіталі, форма яких також нагадує об'ємні вісімки в різних комбінаціях. Електрони, що знаходяться на s-, p-, d- і f-орбіталях дещо відрізняються один від одного по енергії. Орбіталь, на якій знаходиться електрон позначають за допомогою цифри та букви. Цифра позначає енергетичний рівень, а буква – підрівень, тобто вид орбіталі на якому знаходиться електрон. Наприклад, позначення 1s – це s-підрівень, що знаходиться на першому (найближчому до ядра) енергетичному рівні. Цей підрівень складається з єдиної 1s-орбіталі. 2p - це p- підрівень, що знаходяться на 2-у електронному рівні. Такий 2p- підрівень складається вже з трьох однакових px-, py- і pz-орбіталей. Таким чином, електрони в атомах можуть знаходитися на різних рівнях, підрівнях і орбіталях. Залежно від підрівня їх називають s-, p-, d- і f-електронами. Елементи, у яких зовнішні (тобто найбільш віддалені від ядра) електрони знаходяться на s-підрівні, називають s-елементами. Так само визначають p-елементи, d-елементи і f-елементи. §2.5. Квантові числа електронів Стан кожного електрона в атомі визначається чотирма параметрами – квантовими числами: головним (n), орбітальним (l), магнітним (m) і спіновим (s). Перші три характеризують рух електрона в просторі, а четверте - навколо власної осі.
Електрони які знаходяться на одній орбіталі утворюють ЕНЕРГЕТИЧНІ (або електронні)РІВНІ. Нумерація рівнів починається від ядра: 1, 2, 3, 4, 5, 6, 7 або К, L, M, N, О, P, Q Кожна орбіталь характеризується набором квантових чисел: n – головне квантове число – характеризирует енергію орбіталі і відстань від ядра; l – побічне квантове число – характеризирует форму орбіталі; m – магнітне квантове число – характеризирует орієнтацію орбіталей в просторі; s – квантове число спину – характеризирует орієнтацію спину [+1/2; -1/2].
ГОЛОВНЕ квантове число (n). Визначає енергетичний рівень електрона, віддаленість рівня від ядра, розмір електронної хмари. Приймає цілі значення (n = 1, 2, 3...) і відповідає номеру періоду. З періодичної системи для будь-якого елементу по номеру періоду можна визначити число енергетичних рівнів атома і який енергетичний рівень є ЗОВНІШНІМ. Приклад. Елемент кадмій Cd розташований в п'ятому періоді, значить n = 5. В його атомі електрони розподілені по п'яти енергетичних рівнях (n = 1, n = 2, n = 3, n = 4, n = 5); зовнішнім буде п'ятий рівень (n = 5).
Оскільки рівні вже мають головне квантове число n, для підрівнів ввели допоміжне ОРБІТАЛЬНЕ квантове число l. Якщо головне квантове число n - це “адреса” рівня, то число l - “адреса” підрівня: l = 0 – це s-підрівень, s-орбіталь – орбіталь сфера l = 1 – це p- підрівень, p-орбіталь – орбіталь гантель l = 2 – це d- підрівень, d-орбіталь – орбіталь складної форми l = 3 – це f- підрівень, f-орбіталь – орбіталь ще складнішої форми.
ОРБІТАЛЬНЕ квантове число (l) характеризує геометричну форму орбіталі. l змінюється від 0 до (n - 1). Незалежно від номера енергетичного рівня, кожному значенню орбітального квантового числа відповідає орбіталь особливої форми. Набір орбіталей з однаковими значеннями n називається ЕНЕРГЕТИЧНИМ РІВНЕМ, з однаковими n і l – підрівнем.
На першому енергетичному рівні (n = 1) орбітальне квантове число l приймає єдине значення l = (n – 1) = 0. Форма орбіталі - сферична; на першому енергетичному тільки один підрівень - 1s. Для другого енергетичного рівня (n = 2) є два підрівні - 2s і 2p. Для третього енергетичного рівня (n = 3) три енергетичні підрівні – 3s, 3p і 3d. МАГНІТНЕ квантове число (m) характеризує положення електронної орбіталі в просторі. Це квантове число приймає значення від -l до +l, тобто має рівно стільки значень, на скільки нових ліній розщеплюється кожна з s- p- d- і f-ліній в магнітному полі. І кількість цих нових ліній відповідає числу орбіталей в підрівні. Це означає, що для кожної форми орбіталі існує (2l + 1) енергетично рівноцінних орієнтації в просторі. - Для s-орбіталі (l = 0) таке положення одне і відповідає m = 0. Сфера не може мати різних орієнтацій в просторі. - Для p-орбіталі (l = 1) - три рівноцінні орієнтації в просторі (2l + 1 = 3): m = -1, 0 +1. - Для d-орбіталі (l = 2) - п'ять рівноцінних орієнтацій в просторі (2l + 1 = 5): m = -2, -1, 0 +1 +2. Таким чином, на s-підрівні - 1, на p- підрівні - 3, на d- підрівні - 5, на f- підрівні - 7 орбіталей. Давайте за допомогою вже відомих нам трьох квантових чисел n, l і m запишемо “адресу”, орбіталі, яка виділена на мал. 2.5. Потім ми зможемо цим же способом записувати “адреси” будь-кого інших орбіталей і електронів, що знаходяться на них. Виділена орбіталь знаходиться на 3-му рівні: отже, її головне квантове число n = 3. Ця орбіталь знаходиться на d-підрівні: отже, її допоміжне квантове число l = 2. Нарешті, для цієї орбіталі магнітне квантове число m = -2. Отже, “адреса” виділеної орбіталі: n = 3, l = 2, m = -2.
СПІНОВЕ квантове число (s) характеризує магнітний момент, що виникає при обертанні електрона навколо своєї осі. Приймає тільки два значення +1/2 і –1/2 відповідні протилежним напрямкам обертання електрона. Якщо на орбіталі знаходяться два електрони з протилежними спинами, то такі електрони називаються спареними.
 . .
ПРИНЦИПИ ЗАПОВНЕННЯ ОРБІТАЛЕЙ Подібно до будь-якої природної системи чи об'єкта, атом кожного елемента намагається мати мінімальну енергію. Це можливо лише за певного розміщення електронів по орбіталях згідно з такими правилами (принципами):
На одній електронній орбіталі може міститися не більше двох електронів. Можна порахувати, що на n- рівні поміщається в сумі n2 різних орбіталей, а електронів - удвічі більше: 2n2, тому що будь-яка орбіталь здатна вміщати не більше двох електронів.
Таблиця 2.4. Найбільше можливе число електронів на перших 4-х електронних рівнях.
2. Правило Гунда – електрони розмішуються на однакових орбіталях так, щоб їхній спін був максимальним:
Мал. 2.6. Правильна (а) і неправильна (б) орбітальна діаграма Нітрогену N. Відповідно до правила Гунда орбіталі спочатку заселяються одиночними, а не спареними електронами.
Орбiталі називають також ЕЛЕКТРОННИМИ КОМІРКАМИ. Якщо в комірці знаходяться 2 електрони – це " спарені" електрони. 3. Правило Клечковського (принцип найменшої енергії). В основному стані кожний електрон розташовується так, щоб його енергія була мінімальною. Чим менша сума (n + l), тим менша енергія орбіталі. При однаковому значенні (n + l) найменшу енергію має орбіталь з меншим n. Енергія орбіталей зростає в ряду: 1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 5d» 4f < 6p < 7s. На мал. 2.7 показано орбітальні діаграми і електронні формули деяких елементів. Цей малюнок допомагає легко зрозуміти прості правила заповнення електронних оболонок в атомах.
Мал. 2.7. Електронні конфігурації деяких елементів. §2.6. Електронні формули елементів Запис, що відображає розподіл електронів в атомі по енергетичних рівнях і підрівнях, називається ЕЛЕКТРОННОЮ КОНФІГУРАЦІЄЮ цього атома. В основному (НЕЗБУДЖЕНОМУ) стані атома всі електрони задовольняють принципу мінімальної енергії. Це значить, що спочатку заповнюються підрівні, для яких: 1) Головне квантове число n мінімальне; 2) Усередині рівня спочатку заповнюється s- підрівень, потім p- і лише потім d- (l мінімальне); 3) Заповнення відбувається так, щоб (n + l) було мінімальне (правило Клечковського); 4) У межах одного підрівня електрони розташовуються так, щоб їх сумарний спін був максимальний, тобто містив найбільше число неспарених електронів (правило Гунда). 5) На енергетичному рівні з номером n може бути не більше ніж 2n2 електронів, розташованих на n2 підрівнях.
КОЖЕН ЕЛЕМЕНТ МАЄ СВОЮ ІНДИВІДУАЛЬНУ
|