Заняття 26Лабораторна робота №4. Тема: Гідроліз солей Актуальність: Електролітична дисоціація електролітів відіграє важливу роль в різноманітних процесах, у тому числі і в життєдіяльності організмів. Наявність електролітів впливає на розчинність білків, амінокислот і інших органічних сполук в організмі людини. Порушення нормального електролітного балансу має негативні наслідки. Навчальні цілі: Знати: теорію дисоціації кислот, основ і солей, сильні і слабкі електроліти, значення водневого показника в кислому, основному і нейтральному середовищі, типи солей, що піддаються гідролізу. Уміти: писати рівняння дисоціацій кислот, основ і солей, йонні рівняння реакцій та рівняння гідролізу солей, визначати рН середовища за кольором індикатора, складати рівняння гідролізу солей. Самостійна позааудиторна робота студентів ! Написати в робочому зошиті: 1. Написати рівняння реакції гідролізу для таких солей AlCl3; AgNO3; Al2S3; Na2CO3; Pb(CH3COO)2. 2. Виписати, які солі гідролізують:
FеCl3, КНСО3, NH4NO3, Na2S, K2SiO3; ZnSO4; Pb(CH3COO)2, K2Cr2O7. Вказати рН розчину кожної солі. 6Дати відповіді на тести: 1. Гідроліз солей – це: а) процес взаємодії солі з водою, в результаті якої може змінюватись рН середовища; б) розпад солі на йони під впливом молекул води; в) розчинення солей у воді; г) дисоціація солі у воді; д) розплавлення солі. 2. В результаті гідролізу натрій хлориду середовище стає: а) кислим; б) лужним; в) нейтральним; г) слаболужним; д) слабокислим. 3. В результаті гідролізу алюміній сульфату середовище стає: а) кислим; б) лужним; в) нейтральним; г) слаболужним; д) не змінюється. 4. В результаті гідролізу натрій ортофосфату середовище стає: а) кислим; б) лужним; в) нейтральним; г) слабокислим; д) не змінюється. 5. В результаті гідролізу плюмбум (ІІ) нітрату середовище стає: а) кислим; б) лужним; в) слабокислим; г) нейтральним; д) не змінюється. 6. В результаті гідролізу цинк хлориду середовище стає: а) кислим; б) лужним; в) нейтральним; г) слаболужним; д) не змінюється. 7. В результаті гідролізу калій карбонату середовище стає: а) кислим; б) лужним; в) нейтральним; г) слабокислим; д) не змінюється. 8. Яке з наведених рівнянь відповідає реакції гідролізу Na2CO3: а) Na+ + H2O = NaOH + H+; б) CO32− + H2O = HCO3− + OH− ; в) 2Na+ + CO32− = Na2CO3; г) Na2CO3 + 2OH− = 2NaOH + CO32− ; д) сіль не гідролізує; 9. Яке з наведених рівнянь відповідає реакції гідролізу AlCl3? а) Al3+ + H2O = AlOH2+ + H+; б) Cl− + H2O = HCl + OH− ; в) Cl− + H2O = HClO + H+; г) Al3+ + 3Cl− = AlCl3; д) сіль не гідролізує. 10. Яке з наведених рівнянь відповідає реакції гідролізу CH3COONH4? а) NH4+ + H2O = NH4OH + H+; б) NH4+ + OH− = NH3 + H2O; в) CH3COO − + H2O = CH3COOH+ OH− ; г) NH4 + + CH3COO − + H2O = NH4OH + CH3COOH; д) сіль не гідролізує. 11. Яке з наведених рівнянь відповідає реакції гідролізу NaCl? а) Na+ + H2O = NaOH + H+; б) Na+ + Cl− + H2O = NaOH + HCl; в) сіль не гідролізує; г) Cl− + H2O = HCl + OH− ; д) Cl− + H2O = HClO+ H+. 12. Яка сіль не гідролізує? а) CH3COONa; б) ZnSO4; в) (NH4)2CO3; г) NaCl. 13. Яка сіль гідролізує за катіоном? а) KNO3; б) ZnSO4; в) Na2CO3; г) NaCl. 14. Яка сіль гідролізує за аніоном? а) CH3COONa; б) ZnSO4; в) (NH4)2CO3; г) NaCl. 15. Яка сіль гідролізує за катіоном та аніоном? а) CH3COONa; б) ZnSO4; в) (NH4)2CO3; г) AgNO3;.
Контрольні питання 1. Що таке сіль? Назвати приклади солей. 2. Назвати приклади солей утворених а) сильною кислотою і сильною основою; б) сильною кислотою і слабкою основою, в) слабкою кислотою і сильною основою; г) слабкою кислотою і слабкою основою. 3. Що таке гідроліз? 4. Поняття про ступінь гідролізу і константу гідролізу. 5. Які типи солей вступають в реакцію гідролізу, приведіть приклади. 6. Який тип солей не гідролізує. Навести приклади. 7. Гідроліз солей, утворених слабкою основою і сильною кислотою. 8. Гідроліз солей, утворених слабкою кислотою і сильною основою. 9. Гідроліз солей, утворених слабкою кислотою і слабкою основою. 10. Гідроліз солей, утворених багатоосновними кислотами та багатокислотними основами.
Самостійна робота на занятті ! Написати в робочому зошиті: 1. Написати рівняння реакцій гідролізу солей в молекулярному та йонному вигляді, вказати рН розчину: NН4NO3, CuSO4, Na2S, K2CO3, Cr2S3, Al2(SiO3)3. 2. Виписати, які з солей AgCl, A12S3. ZnCl2, Fе2(SO3)3, K2S, CuCO3 гідролізують. а) по катіону; б) по аніону; в) по катіону і аніону; г) не гідролізують. Частина ІІ. НЕОРГАНІЧНА ХІМІЯ
Розділ 9. МЕТАЛИ
План §9.1. Положення металів в періодичній системі хімічних елементів. Метали в природі. §9.2. Загальні фізичні та хімічні властивості металів. Електрохімічний ряд напруг. §9.3. Лужні метали. Будова, фізичні та хімічні властивості. §9.4. Властивості лужноземельних металів. Поняття про твердість води. §9.5. Підгрупа Алюмінію. §9.6. Перехідні метали. Ферум як представник d-елементів.
§9.1. Положення металів в періодичній системі хімічних елементів Якщо в періодичній таблиці елементів Д.І.Менделєєва провести діагональ від Берилію (Ве) до Астату (At), то зліва внизу по діагоналі знаходитимуться елементи-метали (до них же відносяться елементи побічних підгруп), а справа вгорі – елементи-неметали (крім d-елементів). Елементи, розташовані поблизу діагоналі (Be, Al, Ti, Ge, Nb, Sb і ін.), володіють подвійним характером. Зі 110 відомих хімічних елементів 88 є металами (складають 75% усіх елементів).
До елементів - металів відносяться: · всі s - елементи I і II груп (крім Гідрогену та Гелію); · всі d- і f – елементи; · p- елементи головних підгруп: IIIА (окрім Бору), IVА (Ge, Sn, Pb), VА (Sb, Bi) і VIА (Po). Найтиповіші елементи – метали розташовані на початку періодів (починаючи з другого). Атоми містять по два або по одному s – електрону на зовнішньому енергетичному рівні. Виняток складають p- елементи. Для металів ступінь окиснення нуль (0) – найнижчий, отже, вони можуть бути лише відновниками. Відновні властивості металів відображені в електрохімічному ряді напруг металів. Металами є більшість хімічних елементів. Найпоширенішим металом в земній корі є алюміній. Переважна більшість металів зустрічається в природі у вигляді різних сполук і лише деякі з них — у вільному стані. Це так звані самородні метали (золото і платина), а також інколи срібло, ртуть, мідь і інші метали. Мінерали і гірські породи, придатні для добування з них металів заводським способом, називаються рудами. Важливішими рудами є оксиди (Fe2O3, Fe3O4, Al2O3 • nH2O, MnO2 тощо); сульфіди (ZnS, PbS, Cu2S, HgS і ін.), солі (NaCl, KCl, MgCl2 CaCO3 і т. д.). Малоактивні метали зустрічаються переважно у вигляді оксидів і сульфідів, а активні (лужні і лужноземельні) — тільки у вигляді солей. §9.2. Загальні фізичні та хімічні властивості металів Метали в твердому стані – кристалічні речовини з металічним типом зв’язку. Кристалічні гратки металічного типу містять у вузлах позитивно заряджені йони і нейтральні атоми; між ними пересуваються відносно вільні електрони.
Фізичні властивості металів пояснюються особливою будовою кристалічних граток - наявністю вільних електронів (" електронного газу"). Отже, основні фізичні властивості металів: 1) Пластичність – здатність змінювати форму при ударі, витягуватися в дріт, прокатуватися в тонкі листи. У ряді – Au, Ag, Cu, Sn, Pb, Zn, Fe – зменшується. 2) Блиск, звично сірий колір і непрозорість. Це пов'язано з взаємодією вільних електронів з падаючими на метал квантами світла. 3) Електропровідність. Пояснюється направленим рухом вільних електронів від негативного полюса до позитивного під впливом невеликої різниці потенціалів. У ряді – Ag, Cu, Al, Fe – зменшується. При нагріванні електропровідність зменшується, оскільки з підвищенням температури посилюються коливання атомів і йонів у вузлах кристалічних граток, що утруднює направлений рух " електронного газу". 4) Теплопровідність. Зумовлена високою рухливістю вільних електронів і коливальним рухом атомів, завдяки чому відбувається швидке вирівнювання температури по масі металу. Найбільша теплопровідність - у Вісмуту і Меркурію. 5) Твердість. Найтвердіший метал – Хром (ріже скло); найм’якіші – лужні метали – Калій, Натрій, Рубідій і Цезій – ріжуться ножем. 6) Густина – тим менша, чим менша атомна маса металу і чим більший радіус його атома (найлегший - Літій (r=0, 53 г/см3); найважчий – Осмій (r=22, 6 г/см3). Метали, які мають густину r < 5 г/см3 вважаються " легкими металами". 7) Температури плавлення і кипіння. Найбільш легкоплавкий метал – Меркурій (т.пл. = -39°C), найбільш тугоплавкий метал – Вольфрам (t°пл = 1500°C). Метали з t°пл. вище 1000°C вважаються тугоплавкими, нижче – легкоплавкими.
Загальні хімічні властивості металів Хімічні властивості металів визначаються тим, що їх атоми порівняно легко віддають зовнішні (валентні) електрони. При цьому перетворюються на катіони (К+, Са2+). Тому метали вступають у реакції окиснення з різними окисниками, серед яких прості речовини, кислоти, солі менш активних металів тощо.
Метали беруть участь в РЕАКЦІЯХ ЗАМІЩЕННЯ – це реакції, в результаті яких атоми простої речовини заміщують атоми в складній речовині. Fe + CuSO4 = Сu + Fe SO4 Zn + H2SO4 = H2+ Zn SO4 Такі реакції можливі тоді, коли атоми більш активного елементу витісняють атоми менш активного елементу в складній речовині.
Електрохімічний ряд напруг металів:
Цей ряд характеризує хімічні властивості металів: 1. Чим лівіше в цьому ряді розташований метал, тим сильніші його відновні властивості і тим слабші окисні властивості його йона в розчині (тобто тим легше він віддає електрони (окиснюється) і тим важче його йони приєднують назад електрони). 2. Кожний метал здатний витісняти з розчинів солей ті метали, які стоять у ряді напруг правіше за нього, тобто відновлює йони наступних металів в електронейтральні атоми, віддаючи електрони – а сам перетворюється на йон. 3. Тільки метали, що стоять у ряді напруг лівіше за Гідроген (Н), здатні витісняти його з розчинів кислот (наприклад, Zn, Fe, Pb – але не Сu, Hg, Ag). Хлоридна кислота (HCl) – слабкий окисник за рахунок йонів Н+, тому вона взаємодіє лише з металами, які стоять в ряду стандартних електродних потенціалів перед воднем, наприклад: 2 HCl + Mg ® MgCl2 + H2 HCl + Cu ≠
Схема взаємодії сульфатної кислоти (H2SO4) з металами:
Під час взаємодії з активними металами (наприклад, із магнієм) в залежності від концентрації і температури паралельно відбуваються кілька реакцій з утворенням сполук Cульфуру, в яких S має різні ступені окиснення (S+4O2, S0, H2S-2); однак переважають реакції з утворенням S0 і H2S.
Внаслідок взаємодії з малоактивними металами (наприклад, міддю) утворюються сіль та сульфур (ІV): оксид Cu + 2H2SO4(к) ® CuSO4 + SO2 + 2H2O У випадку розведеної сульфатної кислоти метали реагують з нею аналогічно хлоридній кислоті, тобто виділяється водень: Zn + H2SO4 (р) ® ZnSO4 + H2 Нітратна кислота (HNO3) – сильний окисник. Внаслідок взаємодії з металами водень не виділяється, він окиснюється з утворенням води. Схема взаємодії нітратної кислоти з металами:




      
Приклади: a)
б) 4
в)
г) 4
Не реагує нітратна кислота з платиною (Pt), золотом (Au), родієм (Rh), талієм (Tl), іридієм (Ir), пасивує (при звичайній температурі): алюміній (Al), хром (Cr), залізо (Fe).
§9.3. Лужні метали. Будова, фізичні та хімічні властивості. ЛУЖНИМИ називаються метали, що розташовані в І А групі періодичної системи. Усі вони мають загальну електронну формулу зовнішнього рівняння ns1. Є активними металами.
Фізичні властивості. Низькі температури плавлення, мала густина, м'які, ріжуться ножем. Хімічні властивості. Типові метали, ДУЖЕ СИЛЬНІ ВІДНОВНИКИ. В сполуках проявляють єдиний ступінь окиснення +1. Із збільшенням атомної маси зростає відновна здатність: Li ® Na ® K ® Rb ® Cs. Всі сполуки мають йонний характер, майже всі розчинні у воді. ГІДРОКСИДИ R–OH – луги (сильні основи), сила їх зростає зі збільшенням атомної маси металу. Спалахують на повітрі при помірному нагріванні. З воднем утворюють солеподібні гідриди. Згоряють найчастіше до пероксидів.
Найважливіші Сполуки лужних металів · Оксиди (R2O) І ПЕРОКСИДИ (R2O2)
· ГІдроксиди (ROH)
§9.4. Властивості лужноземельних металів. Твердість води. ЛУЖНО-ЗЕМЕЛЬНІ метали знаходяться в ІІ А групі періодичної таблиці. Усі вони мають загальну електронну формулу зовнішнього рівня ns2. Є активними металами.
Хімічні властивості 1. Дуже реакційноздатні. 2. Володіють сталою валентністю ІІ (ступінь окиснення +2). 3. Реагують з водою при кімнатній температурі (крім Be) з виділенням водню. Метали головної підгрупи II групи - СИЛЬНІ ВІДНОВНИКИ; в сполуках проявляють тільки ступінь окиснення +2. Активність металів і їх відновна здатність збільшується в ряду: – Вe–Mg–Ca–Sr–Ba
Найважливіші Сполуки лужноземельних металів · Оксиди (RO)
· ГІдроксиди R(OH)2
§9.5. ПІДГРУПА АЛЮМІНІЮ До підгрупи алюмінію входять елементи ІІІ А групи, головної підгрупи періодичної системи. Усі вони мають загальну електронну формулу зовнішнього рівняння ns2nр1.
Фізичні властивості. Із збільшенням атомної маси посилюється металічний характер елементів (В – неметал; інші – метали). Бор значно відрізняється за властивостями від інших елементів (високі температури плавлення та кипіння, твердість; інертність). Решта елементів – легкоплавкі метали, In і Tl - дуже м'які. Хімічні властивості 1. Всі елементи трьохвалентні, але з підвищенням атомної маси набуває значення валентність, рівна одиниці (Tl в основному одновалентний). 2. Основність гідроксидів R(OH)3 зростає зі збільшенням атомної маси (H3BO3 – слабка кислота, Al(OH)3 і Ga(OH)3 - амфотерні основи, Іn(OH)3 і Tl(OH)3 - типові основи, TlOH - сильна основа). 3. Метали підгрупи алюмінію (Al, Ga, In, Tl) хімічно достатньо активні (реагують з кислотами, лугами (Al, Ga), галогенами). 4. Солі елементів підгрупи алюмінію в більшості випадків піддаються гідролізу по катіону. Стійкі лише солі одновалентного талію. 5. Al і Ga захищені тонкою оксидною плівкою; Tl руйнується при дії вологого повітря (бережуть в гасі).
Ø Алюміній (Al) Хімічні властивості Алюміній – покритий тонкою і міцною оксидною плівкою (не реагує з простими речовинами: з H2O (t°); O2, HNO3 (без нагрівання)). Al – активний метал – ВІДНОВНИК.
Найважливіші Сполуки алюмінію · Оксид алюмінію (Al2O3 O=Al–O–Al=O)
· Гідроксид алюмінію (Al(ОН)3)
|





 +
+  =
=  +
+  + 2H2O
+ 2H2O

 + 2e ®
+ 2e ® 
 = 3
= 3  + 4H2O
+ 4H2O
 = 4
= 4  + 4H2O
+ 4H2O

 + 4
+ 4  =
=  + 2
+ 2  + 2H2O
+ 2H2O
 + 1e ®
+ 1e ® 
 + 10Н
+ 10Н  (к) = 4
(к) = 4  +
+  + 5H2O
+ 5H2O

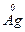 + 4H
+ 4H  NO3 +
NO3 +  O + 2H2O
O + 2H2O + 3H2O
+ 3H2O



