Основные расчетные соотношенияХимическим реактором называется аппарат, в котором осуществляется ХТП или отдельные его стадии, включающие химические превращения. По кинематике потоков на входе и выходе (режиму подачи реакционной смеси) различают реакторы периодического (Wвх=Wвых =0), непрерывного (Wвх=Wвых> 0) и полупериодического (Wвх > 0; Wвых = 0 или Wвх = 0; Wвых > 0) действия. Процессы, протекающие в таких реакторах, соответственно называют периодическими, непрерывными и полупериодическими. Все периодические и полупериодические процессы нестационарны, т.е. характеризуются изменением во времени параметров реакционной смеси. Если время полного обмена реакционной смеси в реакторе назвать временем цикла tц, то при любой кинематике потока tц = tзагр + tхим.р. + tвыгр, (3.9) где tзагр. и tвыгр - время загрузки и выгрузки; tхим.р - продолжительность реакции, приводящей к заданной степени превращения. Если интервалы времени tзагр., tхим.р. и tвыгр совпадают, процесс непрерывный и tц = tхим.р. Если эти интервалы не совпадают и следуют один за другим - процесс периодический и tц находят по формуле (3.9). Если один из интервалов tзагр или tвыгр совпадает с tхим.р. - процесс полупериодический и tц = tзагр + tхим.р. или tц = tхим.р. + tвыгр. Однако во всех случаях с помощью характеристических уравнений находят время пребывания, равное tхим.р. Для реакторов непрерывного действия связь времени пребывания реагентов с размерами реактора и скоростью потока выражается уравнением tу = V/W1, (3.1)
где tу - условное время полного обмена реакционной смеси в реакторе; V- объем реактора, м3; W1- объемный расход реакционной смеси на входе, м3/ч. Для реактора с постоянным сечением tу = h/w1, (3.2) где h – высота реактора, м; w1 - линейная скорость потока на входе, м/ч. Связь времени пребывания реагентов с факторами технологического режима (концентрацией реагентов, температурой, давлением, степенью превращения и др.) описывается выражением tд = V/W2 = f(CA, 0, XA, T, P …). (3.3) Здесь tд - время, необходимое для достижения заданной степени превращения; W2 - объемный расход реакционной смеси на выходе, м3/ч. В общем случае W1=W0(1+xAXA, 1) и W2=W0(1+xAXA, 2), (3.3’) где W0 - расход потока при ХA=0; XA, 1=aх, 1ХА*; XA, 2 =aх, 2ХА*- степень превращения реагента А в потоках на входе и на выходе из реактора соответственно. Здесь aх – степень приближения к равновесной степени превращения. Математическая модель или характеристическое уравнение реактора получается, если tу = tд для реакций, протекающих без изменения объема, когда xA =0, т.е. при W1= W2=W0: tд= V/W0 =tу = f(CA, 0, XA1, T, P, …). (3.4) Если xA ¹ 0, tу =V/W1 = Умножив (3.5) на отношение приращений расходов при XA, 1 и XA, 2, получим:
Так как tд =
Определяя время пребывания по расходу при ХА=0, получаем выражение, позволяющее упростить совместное решение уравнений материального и теплового балансов реактора:
По характеру движения технологических потоков, определяющему эффективность контакта между реагентами, различают гидродинамические режимы смешения и вытеснения. Режим полного (идеального) смешения характеризуется одинаковым составом и, как следствие, одинаковыми значениями любых параметров реакционной смеси во всех точках занимаемого ею пространства. Изменения возможны только во времени. Режим полного (идеального) вытеснения характеризуется максимально возможными различиями состава и всех параметров реакционной смеси как в пространстве, так и во времени. Между этими предельными гидродинамическими режимами лежат промежуточные, близость которых к одному из идеальных режимов определяется по распределению времени пребывания отдельных компонентов реакционной смеси в реакторе. Однако при любом гидродинамическом режиме массообмен, сопровождающий химические превращения, описывается уравнениями материального баланса элементарного объема реакционной зоны (режим вытеснения) или всего реакционного объема (режим смешения). В наиболее общей форме они имеют следующий вид: · общая модель режима смешения:
· общая модель режима вытеснения:
Здесь x, y, z - расстояния по направлениям трехмерной системы координат, м; rA - скорость реакции по компоненту А, кмоль/м3с; D - коэффициент молекулярной диффузии, м2/с, r – скорость химической реакции. Для реакций различных порядков расчет скорости проводят по уравнениям: rA=kCAn (3.12) · реакция первого порядка: n=1: rA=kCA, 0(1-XA); · реакция нулевого порядка: n=0: rA=k; · реакция n- го порядка: n=n rA=kCA, 0n(1-XA)n. Тепловая обстановка в реакторе определяется балансом теплоты материальных потоков на входе и выходе, экзо- и эндотермических фазовых переходов и химических превращений, принудительного нагрева и охлаждения реакционной смеси и естественного теплообмена с окружающей средой. В наиболее общей форме тепловые режимы описываются уравнениями: · при переносе массы смешением:
· при переносе массы вытеснением:
Здесь qx.p. - тепловой эффект химической реакции, кДж/кмоль; r и ср - средние плотность (кмоль/м3) и теплоемкость (кДж/кмольЧК); l - коэффициент теплопроводности кДж/мЧсЧК; F - поверхность теплообмена, м2; DТ - разность температур реакционной смеси и внешней среды, К; kт.о. – коэффициент теплообмена, кДж/м2ЧКЧс. Система уравнений (3.10) и (3.12) - это математическая модель всех типов реакторов смешения, а система уравнений (3.11) и (3.13) - всех типов реакторов вытеснения. При этом, если в (3.10) и (3.12) D=0 и l=0, то эта система становится моделью реактора идеального вытеснения, а при D№0 и l№0 - это модель реактора с гидродинамическим режимом вытеснения с частичным перемешиванием (реактор с промежуточным режимом). В последнем случае коэффициенты D и l заменяются на Dэфф. и l эфф. При построении моделей реакторов для упрощения принимаем, что rСр - величина постоянная, равная произведению средних значений плотности r и теплоемкости ср реакционной смеси: rср=0, 1204
|

 = f(CA, 0, XA1, T, P, …) (3.5)
= f(CA, 0, XA1, T, P, …) (3.5) . (3.6)
. (3.6) , окончательное выражение примет вид:
, окончательное выражение примет вид: . (3.7)
. (3.7) . (3.8)
. (3.8) , (3.10)
, (3.10)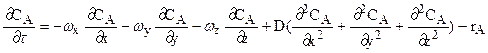 . (3.11)
. (3.11) (3.13)
(3.13)
 . (3.14)
. (3.14) .
.


