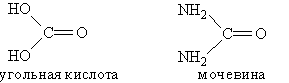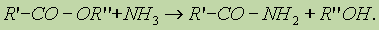Ф КГМА 1-8-21/02
Например:
Общая формула амидов RCONH2. Функциональная группа СONH2 называется амидогруппой. Названия амидов производят от названий кислот, из которых они образовались, с добавлением слова амид. Физические свойства амидов. Амид муравьиной кислоты — жидкость, амиды всех других кислот — белые кристаллические вещества. Низшие амиды хорошо растворимы в воде. Водные растворы амидов дают нейтральную реакцию на лакмус. Важнейшее свойство амидов — способность их к гидролизу в присутствии кислот и щелочей. При этом образуются кислота и аммиак:
К амидам кислот относится мочевина. Это конечный продукт азотистого обмена в организме человека и животных. Образуется при распаде белков и выделяется вместе с мочой. Мочевину можно рассматривать как полный амид угольной кислоты:
Мочевина, или карбамид, — белое кристаллическое вещество, хорошо растворимое в воде. Впервые была получена немецким ученым Велером в 1828 г. из цианата аммония:
Это первое органическое соединение, полученное синтетическим путем. В промышленности мочевину получают из оксида углерода (IV) и аммиака при нагревании (150° С) и высоком давлении:
С сильными минеральными кислотами мочевина образует соли:
Мочевина — ценное высококонцентрированное азотное удобрение (46,6% азота), широко используется на всех почвах и под все культуры. Как источник азота, ее добавляют в корм скоту. Применяется также как исходное вещество для получения мочевиноформальдегидных смол и лекарственных веществ (люминала, веронала и др.). 4. Ряд свойств карбоновых кислот обусловлен наличием углеводородного радикала. Так, при действии галогенов на свету образуются a -галогензамещенные кислоты:
Непредельные карбоновые кислоты способны к реакциям присоединения. 5. Окислительно-восстановительные реакции карбоновых кислот. Карбоновые кислоты при действии восстановителей способны превращаться в альдегиды или спирты:
Насыщенные карбоновые кислоты устойчивы к действию концентрированных серной и азотной кислот. Исключение составляет муравьиная кислота:
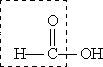
Муравьиная кислота НСООН отличается рядом особенностей, поскольку в ее составе есть альдегидная группа:
Муравьиная кислота — сильный восстановитель и легко окисляется до СО2. Она дает реакцию “серебряного зеркала”:
Кроме того, муравьиная кислота окисляется хлором:
Сложные эфиры. Среди функциональных производных кислот особое место занимают сложные эфиры — производные кислот, у которых атом водорода в карбоксильной группе заменен углеводородным радикалом. Общая формула сложных эфиров
где R и R' — углеводородные радикалы (в сложных эфиpax муравьиной кислоты R — атом водорода).
Номенклатура и изомерия. Названия сложных эфиров производят от названия углеводородного радикала и названия кислоты, в котором вместо окончания -овая используют суффикс -am, например:
Для сложных эфиров характерны три вида изомерии: 1. Изомерия углеродной цепи начинается по кислотному остатку с бутановой кислоты, по спиртовому остатку — с пропилового спирта, например, этилбутирату изомерны этилизобутират, пропилацетат и изопропилацетат. 2. Изомерия положения сложноэфирной группировки —СО—О—. Этот вид изомерии начинаетсясо сложных эфиров, в молекулах которых содержится не менее 4 атомов углерода, например этилацетат и метилпропионат. 3. Межклассовая изомерия, например, метилацетату изомерна пропановая кислота. Для сложных эфиров, содержащих непредельную кислоту или непредельный спирт, возможны еще два вида изомерии: изомерия положения кратной связи и цис-, транс-изомерия. Физические свойства сложных эфиров. Сложные эфиры низших карбоновых кислот и спиртов представляют собой летучие, нерастворимые в воде жидкости. Многие из них имеют приятный запах. Так, например, бутилбутират имеет запах ананаса, изоамилацетат — груши и т. д. Сложные эфиры высших жирных кислот и спиртов — воскообразные вещества, не имеют запаха, в воде не растворимы. Химические свойства сложных эфиров. 1. Реакция гидролиза, или омыления. Так, как реакция этерификации является обратимой, поэтому в присутствии кислот протекает обратная реакция гидролиза:
Реакция гидролиза катализируется и щелочами; в этом случае гидролиз необратим, так как получающаяся кислота со щелочью образует соль:
2. Реакция присоединения. Сложные эфиры, имеющие в своем составе непредельную кислоту или спирт, способны к реакциям присоединения. 3. Реакция восстановления. Восстановление сложных эфиров водородом приводит к образованию двух спиртов:
4. Реакция образования амидов. Под действием аммиака сложные эфиры превращаются в амиды кислот и спирты:
Жиры. Среди сложных эфиров особое место занимают природные эфиры — жиры и масла, которые образованы трехатомным спиртом глицерином и высшими жирными кислотами, содержащими четное число углеродных атомов. Жиры входят в состав растительных и животных организмов и служат одним из источников энергии живых организмов, которая выделяется при окислении жиров. Общая формула жиров:
гдеR', R", R"' — углеродные радикалы. Жиры бывают “простыми” и “смешанными”. В состав простых жиров входят остатки одинаковых кислот (т. е. R’ = R" = R'"), в состав смешанных — различных. В жирах наиболее часто встречаются следующие жирные кислоты: Алкановые кислоты 1. Масляная к-та СН3 — (CH2)2 — СООН 2. Капроновая к-та СН3 — (CH2)4 — СООН 3. Пальмитиновая к-та СН3 — (CH2)14 — СООН 4. Стеариновая к-та СН3 — (CH2)16 — СООН Алкеновые кислоты 5. Олеиновая к-та С17Н33СООН СН3—(СН2)7—СН === СН—(СН2)7—СООН Алкадиеновые кислоты 6. Линолевая к-та С17Н31СООН СН3—(СН2)4—СН = СН—СН2—СН = СН—СООН Алкатриеновые кислоты 7. Линоленовая к-та С17Н29СООН СН3СН2СН = CHCH2CH == CHCH2CH = СН(СН2)4СООН Физические свойства. По агрегатному состоянию при комнатной температуре жиры делятся на жидкие и твердые. Твердые жиры, как правило, образованы предельными кислотами, жидкие жиры (их часто называют маслами) — непредельными. Жиры растворимы в органических растворителях и нерастворимы в воде. Химические свойства. 1. Гидролиз, или омыление, жиров происходит под действием воды (обратимо) или щелочей (необратимо). При щелочном гидролизе образуются соли высших жирных кислот, называемые мылами. 2. Гидрогенизацией жиров называется процесс присоединения водорода к остаткам непредельных кислот, при этом жиры из жидких превращаются в твердые. Мыла — это соли высших карбоновых кислот. Обычные мыла состоят главным образом из смеси солей пальмитиновой, стеариновой и олеиновой кислот. Натриевые соли образуют твердые мыла, калиевые соли — жидкие мыла. Мыла получаются при гидролизе жиров в присутствии щелочей:
Отсюда реакция, обратная этерификации, получила название реакции омыления. Омыление жиров может протекать и в присутствии серной кислоты (кислотное омыление). При этом получаются глицерин и высшие карбоновые кислоты. Последние действием щелочи или соды переводят в мыла. Исходным сырьем для получения мыла служат растительные масла (подсолнечное, хлопковое и др.), животные жиры, а также гидроксид натрия или кальцинированная сода. Растительные масла предварительно подвергаются гидрогенизации, т. е. их превращают в твердые жиры. Применяются также заменители жиров — синтетические карбоновые жирные кислоты с большей молекулярной массой. Производство мыла требует больших количеств сырья, поэтому поставлена задача получения мыла из непищевых продуктов. Необходимые для производства мыла карбоновые кислоты получают окислением парафина. Нейтрализацией кислот, содержащих от 10 до 16 углеродных атомов в молекуле, получают туалетное мыло, а из кислот, содержащих от 17 до 21атома углерода, — хозяйственное мыло и мыло для технических целей. Как синтетическое мыло, так и мыло, получаемое из жиров, плохо моет в жесткой воде. Поэтому наряду с мылом из синтетических кислот производят моющие средства из других видов сырья, например из алкилсульфатов — солей сложных эфиров высших спиртов и серной кислоты. В общем виде образование таких солей можно изобразить уравнениями:
Эти соли содержат в молекуле от 12 до 14 углеродных атомов и обладают очень хорошими моющими свойствами. Кальциевые и магниевые соли растворимы в воде, а потому такие мыла моют и в жесткой воде. Алкилсульфаты содержатся во многих стиральных порошках. Синтетические моющие средства высвобождают сотни тысяч тонн пищевого сырья — растительных масел и жиров.
Ф КГМА 1-8-21/02
|