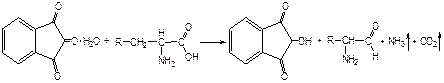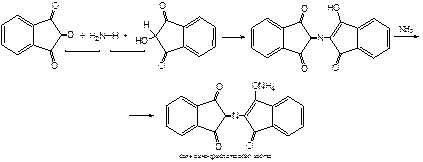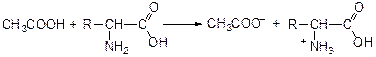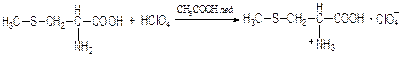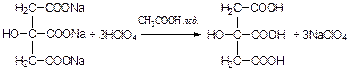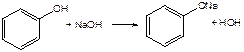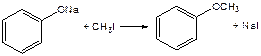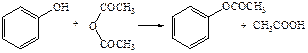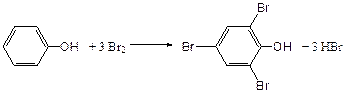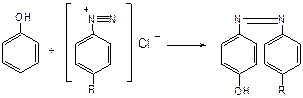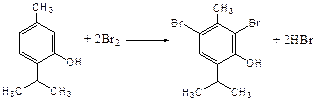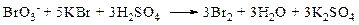Количественное определение альдегидовФармакопейным методом количественного определения лекарственных средств, содержащих в своем составе альдегидную группу является метод йодометрии (обратный способ) в щелочной среде.
Карбоновые кислоты можно рассматривать как производные углеводородов, у которых атом водорода замещен на карбоксильную группу Присутствие карбоксильной группы увеличивает растворимость вещества. Электронная плотность карбоксильной группы смещена в сторону наиболее электроотрицательного атома кислорода карбоксильной группы, вследствие чего связь между кислородом и водородом гидроксила ослабевает, что облегчает отщепление водорода в виде катиона, т.е. наступает диссоциация кислоты, которая зависит от величины и характера радикала, связанного с карбоксильной группой. Химические свойства карбоновых кислот в основном определяются свойствами карбоксильной группы. 1. Органические кислоты растворяются в растворах щелочей и карбонатов щелочных металлов с образованием солей:
2. Со спиртами кислоты образуют сложные эфиры, имеющие характерный запах:
3. С солями тяжелых металлов в нейтральной среде образуются осадки различного цвета:
4. С аминами и аммиаком кислоты образуют амиды:
Отщепление ионогенного водорода карбоксильной группы придаёт карбоновым кислотами раздражающее действие. Чем выше степень диссоциации кислоты, тем больше она проявляет раздражающее, прижигающее действие. Введение в углеводородную цепь гидроксильной группы приводит к образованию оксикислот: Для оксикислот характерны все реакции, что и для карбоновых кислот, кроме того, за счет гидроксильной группы они проявляют восстановительные свойства и могут окисляться сильными окислителями до кетонов. Если гидроксильная группа стоит в α-положении по отношению к карбоксильной группе, происходит окисление с последующим декарбоксилированием (лактат-ион, цитрат-ион):
Введение в молекулу карбоновых кислот аминогруппы приводит к образованию аминокислот
Являясь амфотерными электролитами, аминокислоты существуют в виде биполярных ионов (внутренние соли), как в водных растворах, так и в твёрдом состоянии. Это свойство объясняет растворимость аминокислот в воде:
Одним из характерных свойств аминокислот является их способность легко окисляться до NH3, CO2 и альдегидов с более короткой цепью (взаимодействие с нингидрином). При действии натрия нитритом в кислой среде или кислоты азотной, окисление идёт только по аминогруппе, при этом образуется оксикислота и выделяется азот (N2). Взаимодействие с нингидрином является общегрупповой реакцией идентификации аминокислот. Конечным продуктом реакции является образование аммонийной соли, окрашенной в сине-фиолетовый цвет:
Для аминокислот также характерно образование медных солей, в которых Cu2+ связан дополнительными связями с атомом азота, образуя комплекс темно-синего цвета:
Аминокислоты являются оптически активными соединениями; для их идентификации используют определение удельного вращения. Согласно требованиям ГФУ соли органических кислот со щелочными металлами, аминокислоты и ряд лекарственных средств, представляющих собой органические основания или их соли количественно определяются методом кислотно-основного титрования в неводных средах. Данный метод используют для титрования органических лекарственных средств, которые в водной среде практически бывает невозможно определить методом нейтрализации, либо вследствие плохой растворимости этих веществ, либо вследствие нечеткого перехода окраски индикатора в точке эквивалентности, а также нейтрального характера некоторых солей. Ввиду того, что органические основания являются чаще всего слабыми электролитами, определить их количественно методом нейтрализации не представляется возможным и они определяются методом неводного титрования. Большое количество лекарственных средств является солями органических оснований с минеральными и органическими кислотами и провести количественное определение этих соединений можно также с учетом основных свойств атома азота. Преимущество метода кислотно-основного титрования в неводных средах состоит в том, что он позволяет определить соли органических кислот или оснований по фармакологически активной части молекулы. В основу теории неводного титрования положена протонная теория Бренседа-Лоури, согласно которой нейтрализация рассматривается как процесс, сопровождающийся переходом протона кислоты к основанию. Любой растворитель может выполнить функцию кислоты или основания в зависимости от характера растворённого в нем вещества. Подбирая определенный неводный растворитель можно оттитровать любые кислоты или основания независимо от величины их констант диссоциации. При количественном определении лекарственных средств из групп солей органических кислот со щелочными металлами, аминокислот; оснований и их солей с неорганическими и органическими кислотами в качестве растворителя используют протогенные (отдающие протон водорода) растворители: НСООН, СН3СООН, уксусный ангидрид и др. Молекулы этих растворителей отдают свои протоны и превращаются в основания:
В качестве титранта используют раствор кислоты хлорной, индикатора – кристаллический фиолетовый. Количественное определение метионина (ГФУ):
Механизм реакции:
Количественное определение натрия цитрата (ГФУ):
Фенолы представляет собой ароматические соединения в которых один или несколько атомов водорода в ядре замещены на гидроксилы. Соответственно различают 1,2 и 3-х атомные фенолы. 1. В отличие от алифатических спиртов, фенолы проявляют, хотя и в слабой степени ясно выраженный кислый характер и поэтому обладают способностью растворяться в щелочах с образованием фенолятов
Так как кислый характер фенолов выражен слабо, феноляты в водных растворах сильно гидролизованы и. даже такая слабая кислота как угольная вытесняет фенолы из их солей. 2. Подтвердить наличие ОН- группы в фенолах можно с раствором железа(ІІІ)хлорида, эффект реакции – окрашивание раствора:
3. Фенолы также как и спирты, образуют простые и сложные эфиры: а) образование простых эфиров:
б) образование сложных эфиров:
4) Введение ОН- группы в молекулу бензола приводит к глубокому изменению в свойствах самого ядра. Так, бензол устойчив к окислению, а фенолы легко окисляются; в бензоле атомы водорода замещаются в присутствии катализатора, а в феноле атомы водорода, находящиеся в о - и п - по отношению к фенольному гидроксилу легко замещаются (бромируются, йодируются даже при комнатной температуре):
Эта реакция положена в основу количественного определения фенолов (фенола, резорцина, тимола и т.д.). Реакция окисления: при взаимодействии с гипохлоритами образуются хиноны, которые при взаимодействии с аммиаком или аминами образуют хиноимины, а далее индофенолы:
в) для идентификации фенолов используют их способность вступать в реакцию сочетания с солями диазония в щелочной среде – образование азокрасителя. Реакция высокочувствительная и дает возможность открывать фенолы в малых количествах:
Метод броматометрии: Броматометрия (бромометрия) относится к фармакопейным методам количественного анализа, в качестве реагента, взаимодействующего с определяемым веществом, выступает раствор брома. Растворы брома неустойчивы и очень токсичны, поэтому в качестве титранта не применяются. Источником брома является бромат-бромидная смесь (KBrO3 + KBr). Бром, образующийся при взаимодействии бромат (BrO3-) и бромид (Br-) ионов в кислой среде, вступает в реакцию с определяемым веществом (см. выше).
Метод применяется для количественного определения различных органических веществ, содержащих фенольный гидроксил, первичную ароматическую аминогруппу (фенола, резорцина, салициловой кислоты, сульфаниламидных препаратов, аминобензойных кислот). Существуют два способа броматометрического титрования: прямое и обратное. Фармакопейный метод количественного определения тимола (способ прямого титрования) Раствор анализируемой субстанции подкисляют, добавляют калия бромид и далее титруют смесь раствором калия бромата до исчезновения розовой окраски индикатора (метилового оранжевого). При этом протекают следующие реакции: 1. Образование брома:
2. Бромирование тимола:
После того, как тимол прореагирует, последующая капля титранта приводит к образованию брома, разрушающего индикатор. Раствор обесцвечивается и титрование заканчивают. Параллельно проводят контрольный опыт (холостое титрование) для определения количества титранта, израсходованного на реакцию с индикатором. Фармакопейный метод количественного определения фенола, резорцина (способ обратного титрования) Анализируемый раствор подкисляют, добавляют избыточное количество титранта KBrO3, избыток KBr. Смесь перемешивают и оставляют на время для бромирования.
Избыток брома определяют йодометрически
Аналогично методу броматометрического титрования для количественного определения выше перечисленных групп препаратов можно применить метод йодометрии и йодхлорметрии.
|


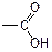 .
.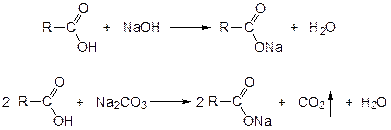
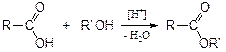
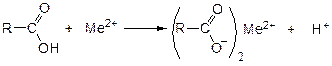
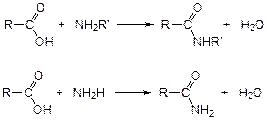
 , которые имеют большую константу диссоциации, чем соответствующие карбоновые кислоты.
, которые имеют большую константу диссоциации, чем соответствующие карбоновые кислоты.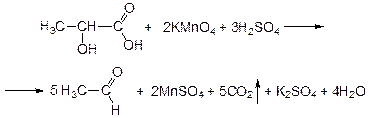
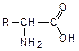 , которые проявляют амфотерные свойства и взаимодействуют как со щелочами, так и с кислотами с образованием солей:
, которые проявляют амфотерные свойства и взаимодействуют как со щелочами, так и с кислотами с образованием солей: