Классификация веществ. Химические свойства неорганических соединений основных классовПри сравнительно небольшом количестве химических элементов (открыто 118 элементов, часть из них получена только искусственным путём) существует бесконечное многообразие химических соединений.
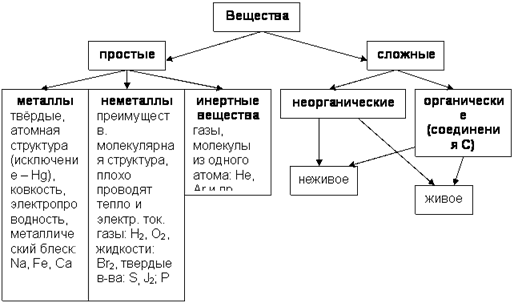
Рис. 1. Упрощенная классификация веществ
По составу, свойствам и наличию различных функциональных групп все сложные неорганические и органические вещества делятся на классы. Классификация сложных неорганических соединений представлена на рис. 2.
Рис. 2. Классификация основных сложных неорганических соединений
Среди сложных неорганических соединений выделяются следующие основные классы: оксиды, гидроксиды, соли. Оксиды – это соединения атомов элементов с кислородом. По составу и химическим свойствам оксиды делятся на основные, кислотные и амфотерные. Основные оксиды – соединения атомов металлов с кислородом (Na2O, CaO, MgO и пр.). Получаются при непосредственном взаимодействии металла с кислородом: 2Na + O2 = 2Na2O, либо при термическом разложении солей: CaCO2 Основные оксиды взаимодействуют с кислотами и кислотными оксидами, образуя соли: 1) CaO + H2SO4 = CaSO4 + H2O CaO + 2H+ + SO42- = Ca2+ + SO42- + H2O CaO + 2H+ = Ca2+ + H2O, 2) СaO + CO2 = CaCO3. При взаимодействии некоторых растворимых основных оксидов с водой образуются основания (щелочи): K2O + H2O = KOH K2O + H2O = K+ + OH-. Кислотные оксиды – соединения атомов неметаллов или некоторых металлов в высшей степени окисления (V+5, Mn+7, Cr+6 и др.) с кислородом. Образуются при взаимодействии атомов элементов непосредственно с кислородом: S + O2 = SO2, при разложении некоторых кислот: H2CO3 Кислотные оксиды взаимодействуют с растворимыми основаниями и основными оксидами с образованием солей: 1) SO2 + 2KOH = K2SO3 + H2O SO2 + 2K+ + 2OH- = 2K+ + SO32- + H2O SO2 + 2OH- = SO32- + H2O, 2) SiO2 + CaO 3) Mn2O7 + 2NaOH = 2NaMnO4 + H2O Mn2O7 + 2Na+ + 2OH- = 2Na+ + 2MnO4- + H2O Mn2O7 + 2OH- = 2MnO4- + H2O. При взаимодействии некоторых кислотных оксидов с водой образуются кислоты: SO3 + H2O = H2SO4 SO3 + H2O = 2H+ + SO42-. Амфотерные оксиды – соединения атомов амфотерных элементов с кислородом (Al2O3, ZnO, BeO, Cr2O3, PbO2 и др.). Образуются при непосредственном окислении атомов элементов кислородом или косвенным путем, проявляют свойства как основных, так и кислотных оксидов: 1) ZnO + H2SO4 = ZnSO4 + H2O ZnO + 2H+ + SO42- = Zn2+ + SO42- + H2O ZnO + 2H+ = Zn2+ + H2O, 2) ZnO + 2NaOH ZnO + 2Na+ + 2OH- = 2Na+ + ZnO22- + H2O ZnO + 2OH- = ZnO22- + H2O. Гидроксиды – это продукты прямого взаимодействия оксидов с водой, либо косвенных процессов. Они делятся на кислотные, основные и амфотерные. Кислоты – вещества, диссоциирующие в растворах с образованием ионов водорода (т. е. доноры протонов). По составу молекул кислоты делятся на бескислородные (HCl, H2S, HJ и др.) и кислородсодержащие (HNO3, H2SO4, H3PO4 и др.) (см. названия основных неорганических кислот и их солей в табл. 1 приложения). По количеству катионов водорода в молекуле кислоты бывают одно- (HNO3, HCl, HJ) и многоосновные (H2SO4, H3PO4, H2S). По характеру диссоциации на ионы в растворе кислоты делятся на сильные (HNO3, H2SO4, HCl) и слабые (H3PO4, H2CO3), (см. величины констант диссоциации сильных и слабых электролитов в табл. 2 приложения). При записи ионно-молекулярных уравнений реакций в растворах слабые кислоты на ионы не расписываются. Характерными химическими свойствами кислот является способность реагировать с основными оксидами, основаниями, амфотерными оксидами и гидроксидами и солями с образованием солей, как одного из продуктов реакции: 1) 2HCl + CaO = CaCl2 + H2O 2H+ + 2Cl- + CaO = Ca2+ + 2Cl- + H2O 2H+ + CaO = Ca2++ H2O, 2) 2HNO3 + Cu(OH)2 = Cu(NO3)2 + 2H2O 2H+ + 2NO3- + Cu(OH)2 = Cu2+ + 2NO3- + 2H2O 2H+ + Cu(OH)2 = Cu2+ + 2H2O, 3) H2SO4 + BaCl2 = BaSO4↓+ 2HCl 2H+ + SO42+ + Ba2+ + 2Cl- = BaSO4↓+ 2H+ + 2Cl- SO42+ + Ba2+ = BaSO4↓. Растворы кислот реагируют с активными металлами (Mg, Zn, Al, Ca и пр.) с образованием солей и выделением газообразного водорода: H2SO4 + Mg = MgSO4 + H2↑ 2H+ + SO42- + Mg0 = Mg2+ + SO42- + H20↑ 2H+ + Mg0 = Mg2++ H20↑. Иначе ведет себя азотная кислота (HNO3). Наличие в ней активного окислителя (N5+) позволяет реагировать даже с малоактивными металлами (Cu, Ag и др.), однако водород при этом не выделяется: 4HNO3 + Cu = Cu(NO3)2 +2NO2 + 2H2O. Более подробно о реакциях кислот различной концентрации и состава с металлами см. в основной учебной литературе. Основания – вещества, диссоциирующие в растворах с образование гидроксид-ионов. По числу гидроксид-ионов в молекуле основания делятся на одно- (NaOH, AgOH) и многокислотные (Ca(OH)2, Fe(OH)3). Большинство оснований нерастворимо в воде. Растворимыми являются основания, образованные щелочными и щелочноземельными металлами (NaOH, KOH, Ca(OH)2, Ba(OH)2 и др.). Основания реагируют с кислотами, кислотными и амфотерными оксидами, солями: 1) Ba(OH)2 + H2SO4 = BaSO4↓+ 2H2O Ba2+ + 2OH- + 2H+ + SO42- = BaSO4↓+ 2H2O, 2) Ca(OH)2 + CO2 = CaCO3↓ + H2O Ca2+ + 2OH- + CO2 = CaCO3↓ + H2O, 3) 2NaOH + BeO + H2O = Na2[Be(OH)4] 2Na+ + 2OH- + BeO + H2O = 2Na+ + [Be(OH)4]2- 2OH- + BeO + H2O = [Be(OH)4]2-, 4) 2KOH + CuSO4 = Cu(OH)2↓ + K2SO4 2K+ + 2OH- + Cu2+ + SO42- = Cu(OH)2↓ + 2K+ + SO42- 2OH- + Cu2+ = Cu(OH)2↓. Некоторые гидроксиды обладают не только основными, но и кислотными свойствами, их называют амфотерными. К ним относятся гидроксиды амфотерных металлов: Zn(OH)2, Be(OH)2, Al(OH)3, Pb(OH)2, Sn(OH)2, Cr(OH)3 и др. Например: 1) Zn(OH)2 + 2KOH = K2[Zn(OH)4] Zn(OH)2 + 2K+ + 2OH- = 2K+ + [Zn(OH)4]2- Zn(OH)2 + 2OH- = [Zn(OH)4]2-, 2) Zn(OH)2 + 2HCl = ZnCl2 + 2H2O Zn(OH)2 + 2H+ + 2Cl- = Zn2+ + 2Cl- + 2H2O Zn(OH)2 + 2H+ = Zn2+ + 2H2O. Соли – продукты полного или частичного замещения ионов водорода в молекуле кислоты ионами металлов или продукты полного или частичного замещения гидроксид-ионов в молекуле основания кислотными остатками. При полном замещении ионов водорода в молекуле кислоты на ионы металлов образуются средние (нормальные) соли: H2SO4 + 2NaOH = Na2SO4 + 2H2O 2H+ + SO42- + 2Na+ + 2OH- = 2Na+ + SO42- + 2H2O 2H+ + 2OH- = 2H2O. Na2SO4 – сульфат натрия (средняя соль). Кислые соли (гидросоли) образуются при неполном замещении H2CO3 + KOH = KHCO3 + H2O недостаток H2CO3 + K+ + OH- = K+ + HCO3- + H2O H2CO3 + OH- = HCO3- + H2O. KHCO3 – гидрокарбонат калия (кислая соль). Основные соли (гидроксосоли) образуются при частичном замещении гидроксид-ионов в молекуле основания кислотными остатками. Cu(OH)2 + HNO3 = CuOH(NO3) + H2O недостаток Cu(OH)2 + H+ + NO3- = CuOH+ + NO3- + H2O Cu(OH)2 + H+ = CuOH+ + H2O. CuOH(NO3) –нитрат гидроксомеди (II) (основная соль). Соли вступают в химические реакции с кислотами, растворимыми основаниями и другими солями. Обязательным условием последнего процесса является растворимость обеих солей в воде (см. табл. 3 приложения). Примеры: 1) BaCl2 + H2SO4 = BaSO4↓+ 2HCl Ba2+ + 2Cl- + 2H+ + SO42+ = BaSO4↓+ 2H+ + 2Cl- Ba2+ + SO42+ = BaSO4↓, 2) CuSO4 + 2KOH = Cu(OH)2↓ + K2SO4 Cu2+ + SO42- +2K+ + 2OH- = Cu(OH)2↓ + 2K+ + SO42- Cu2+ + 2OH- = Cu(OH)2↓, 3) NaCl + AgNO3 = AgCl↓ + NaNO3 Na+ + Cl- + Ag+ + NO3- = AgCl↓ + Na+ NO3- Cl- + Ag+ = AgCl↓. 2. Углеводы УГЛЕВОДЫ (сахара), обширная группа полигидроксикарбо-нильных соед., входящих в состав всех живых организмов; к углеводам относят также мн. производные, получаемые при хим. Mодификации этих соед. путем окисления,восстановления или введения разл. заместителей. Термин "углеводы" возник потому, что первые известные представители углеводов по составу отвечали ф-ле CmH2nOn (угле-род+вода); впоследствии были обнаружены природные углеводы с др. элементным составом. Классификация и распространение. Углеводы принято делить на моносахариды, олигосахариды и полисахариды. Моносахариды обычно представляют собой полигид-роксиальдегиды (альдозы) или полигидроксикетоны (кетозы) с линейной цепью из 3-9 атомов С, каждый из к-рых (кроме карбонильного) связан с группой ОН. Простейший моноса-харид, глицериновый альдегид, содержит один асим. атом С и известен в виде двух оптич. антиподов (D и L). Прочиемоносахариды имеют неск. асим. атомов С; их рассматривают как производные D- или L-глицеринового альдегида и относят к D- или L-ряду в соответствии с абс. конфигурацией асим. атома С, наиб. удаленного от карбонильной группы. Различия между изомерными моносахаридами в каждом ряду обусловлены относит, конфигурацией остальных асим. центров. Характерное св-во моносахаридов в р-рах - мутаротация, т. е. установление таугомерного равновесия между ациклич. альдегидо- или кетоформой, двумя пятичленными (фураноз-ными) и двумя шестичленными (пиранозными) полуацеталь-ными формами. Две пиранозы (как и две фуранозы) отличаются друг от друга конфигурацией (a или b) нового асим. (аномерного) центра, возникающего из карбонильного атома С при циклизации. Полуацетальный (гликозидный) гидроксил циклич. форм моносахаридов резко отличается от прочих групп ОН моно-сахарида значительно большей склонностью к р-циям нукле-оф. замещения. Такие р-ции приводят к образованию глико-зидов (остаток нуклеофила в гликозиде - напр. спирта. меркаптана - носит назв. агликон). В тех случаях, когдаагликоном служит др. молекула моносахарида, образуются олиго- и полисахариды. При этом каждый остатокмоносахарида может в принципе иметь пиранозную или фуранозную форму, a- или -конфигурацию гликозидного центра и быть связанным с любой из гидроксильных групп соседнего моносахарида. Поэтому число разл. по строению полимерных молекул, к-рые теоретически можно построить даже из остатков только одного моносахарида, представляет собой аст-рономич. величину. К наиб, обычным и распространенным в природе моноса-харидам относят D-глюкозу, D-галактозу, D-маннозу, D-фрук-тозу, D-ксилозу, L-арабинозу и D-рибозу. Из представителей др. классов моносахаридов часто встречаются: 1) дезоксиса-хара, в молекулах к-рых одна или неск. групп ОН заменены атомами H (напр., L-рамноза, L-фукоза, 2-дезокси-D-рибоза); 2) аминосахара, где одна или неск. групп ОН заменены на аминогруппы (напр., 2-амино-2-дезокси-D-глюкоза, или D-глюкозамин); 3) многоатомные спирты (полиолы, альди-ты), образующиеся при восстановлениикарбонильной группы моносахаридов (D-сорбит из D-глюкозы, D-маннит из D-маннозы, и др.); 4) уроно-вые кислоты -альдозы, у к-рых группа CH2OH окислена в карбоксильную (напр., D-глюкуроновая к-та); 5) разветвленные сахара, содержащие нелинейную цепь углеродных атомов (напр., апиоза, или 3-С- гидроксиметил-D-глицеро-тетроза; ф-ла I); 6) высшие сахара с длиной цепи более шести атомов С (напр., D-седогеп-тулоза и сиаловые к-ты; ф-лы см. соотв. в статьях Пентозо-фосфатный цикл и Моносахариды}.
За исключением D-глюкозы и D-фруктозы своб. моносахариды встречаются в природе редко. Обычно они входят в состав разнообразных гликозидов, олиго- и полисахаридов и м. б. получены из них после кислотного гидролиза. Разработаны многочисл. методы хим. синтеза редких моносахаридов исходя из более доступных. Олигосахариды содержат в своем составе от 2 до 10-20 моносахаридных остатков, связанных гликозидными связями. Наиб, распространены дисахариды, выполняющие ф-цию запасных B-B: сахароза в растениях, трегалоза в насекомых и грибах, лактоза в молоке млекопитающих. Известны многочисл. гликозиды олигосахаридов, к к-рым относят разл. физиологически активные в-ва, напр, гликозиды сердечные, нек-рые сапонины (в растениях), мн. антибиотики (в грибах и бактериях), гликолипиды. Полисахариды- высокомол. соед., линейные или разветвленные молекулы к-рых построены из остатковмоносахаридов, связанных гликозидными связями. В состав полисахаридов могут входить также заместители неуглеводной природы (остатки алифатич. к-т, фосфат, сульфат). В свою очередь цепи высших олигосахаридов иполисахаридов могут присоединяться к полипептидным цепям с образованием гликопротеинов. Особую группу составляют биополимеры, в молекулах к-рых остатки полиолов, гликозилполиолов, нуклеозидов или моно- и олигосахаридов соединены не гликозидными, а фос-фодиэфирными связями. К этой группе относяттейхоевые кислоты бактерий, компоненты клеточных стенок нек-рых дрожжей, а также нуклеиновые кислоты, в основе к-рых лежит поли-D-рибозофосфатная (РНК) или поли-2-дезок-си-D-рибозофосфатная (ДНК) цепь. Физико-химические свойства. Обилие полярных функц. групп в молекулах моносахаридов приводит к тому, что эти в-ва легко раств. в воде и не раств. в малополярных орг. р-рителях. Способность к таутомерным превращениям обычно затрудняет кристаллизацию моно- и олигосахаридов, однако если такие превращения невозможны (напр., как в гликозидах и невосстанавливающих олигосахаридах типа сахарозы), то в-ва кристаллизуются легко. Mн. гликозиды с малополярными агликонами (напр., сапонины) проявляют св-ва ПАВ. Полисахариды - гидрофильные полимеры, мн. из них образуют высоковязкие водные р-ры (растит, слизи, гиалуроно-вая к-та; ф-лу последней см. в ст. Мукополисахариды), а в ряде случаев (в результате своеобразной межмол. ассоциации) - прочные гели (агар, алъгиновые кислоты, каррагинаны, пектины). Нек-рые полисахариды образуют высокоупорядоченные надмолекулярные структуры, препятствующие гидратации отдельных молекул; такиеполисахариды (напр., хитин, целлюлоза)не раств. в воде. Биологическая роль. Ф-ции углеводов в живых организмах чрезвычайно многообразны. В растениях моносахаридыявляются первичными продуктами фотосинтеза и служат исходными соед. для биосинтеза гликозидов иполисахаридов, а также др. классов B-B (аминокислот, жирных K-T, фенолов и др.). Эти превращения осуществляютсяферментами, субстратами для к-рых служат, как правило, богатые энергией фос-форилир. производные Сахаров, гл. обр. нуклеозиддифосфат-сахара. Углеводы запасаются в растениях (в виде крахмала), животных, бактериях и грибах (в виде гликогена), где служат энергетич. резервом. Источником энергии являются р-ции расщепления глюкозы, образующейся из этихполисахаридов, по гликоли-тич. или окислит. пути (см. Гликолиз). В виде гликозидов в растениях и животных осуществляется транспорт разл. метаболитов. Полисахариды и более сложные углеводсодержащие полимерывыполняют в живых организмах опорные ф-ции. Жесткая клеточная стенка у высших растений представляет собой сложный комплекс из целлюлозы, гемицеллюлоз и пектинов. Армирующим полимером в клеточной стенке бактерий служат пептидогликаны (муреины), а в клеточной стенке грибов и наружных покровах членистоногих - хитин. Ворганизме животных опорные ф-ции выполняют протео-гликаны соединит, ткани, углеводная часть молекул к-рых представлена сульфатир. мукополисахаридами. Эти в-ва участвуют в обеспечении специфич. физ.-хим. CB-B такихтканей, как кости, хрящи, сухожилия, кожа. Будучи гидрофильными полианионами, эти полисахариды способствуют также поддержанию водного баланса и избират. ионной проницаемости клеток. Аналогичные ф-ции в морских многоклеточных водорослях выполняют сульфатир. галактаны (красные водоросли) или более сложные сульфатир. гетерополисахари-ды (бурые и зеленые водоросли); в растущих и сочных тканях высших растений эту ф-цию выполняют пектины. Особенно ответственна роль сложных углеводов в образовании клеточных пов-стей и мембран и придании им специфич. св-в. Так, гликолипиды - важнейшие компоненты мембран нервных клеток и оболочек эритроцитов, алипополисахариды -наружной оболочки грамотрицат. бактерий. Углеводы клеточной пов-сти часто определяютспецифичность иммунологич. р-ций (групповые в-ва крови, бактериальные антигены) и взаимод. клеток с вирусами. Углеводные структуры принимают участие и в др. высокоспецифич. явлениях клеточного взаимод., таких, как оплодотворение, узнавание клеток при тканевой дифференциации, отторжение чужеродных тканей и т. д. Практическое использование. Углеводы составляют главную часть пищ. рациона человека, в связи с чем широко используются в пищ. и кондитерской пром-сти (крахмал, сахароза и др.). Кроме того, в пищ. технологии применяют структурир. в-ва полисахаридной природы, не имеющие сами по себе пищ. ценности,- гелеобразователи, загустители,стабилизаторы суспензий и эмульсий (альгинаты, агар, пектины, растит. галактоманнаны и др.). Превращения моносахаридов при спиртовом брожении лежат в основе процессов получения этанола, пивоварения, хлебопечения; др. виды брожения позволяют получать из Сахаров биотехнол. методами глицерин, молочную, лимонную, глюконовую к-ты и мн. др. в-ва. Глюкозу, аскорбиновую к-ту, углеводсодержащие антибиотики, гепарин широко применяют в медицине. Целлюлозаслужит основой для получения вискозного волокна, бумаги, нек-рых пластмасс, BB и др. Сахарозу и растит, полисахари-ды рассматривают как перспективное возобновляемое сырье, способное в будущем заменить нефть в пром. орг. синтезе. Моносахариды используют в качестве доступных хиральных исходных соед. для синтеза сложных прир. B-B неуглеводной природы.
|


 CaO + CO2.
CaO + CO2. CO2 + H2O, либо в ходе окислительно-восстановительных реакций: 2SO2 + O2 = 2SO3.
CO2 + H2O, либо в ходе окислительно-восстановительных реакций: 2SO2 + O2 = 2SO3. Na2ZnO2 + H2O
Na2ZnO2 + H2O




