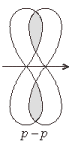Билет № 121. КОВАЛЕНТНАЯ СВЯЗЬ - это связь, возникающая между атомами за счет образования общих электронных пар (Например, H2, HCl, H2O, O2). По степени смещенности общих электронных пар к одному из связанных ими атомов ковалентная связь может быть полярной и неполярной. А) КОВАЛЕНТНАЯ НЕПОЛЯРНАЯ СВЯЗЬ (КНС) - образуют атомы одного и того же химического элемента - неметалла (Например, H2, O2, О3). Механизм образования связи. Каждый атом неметалла отдает в общее пользование другому атому наружные не спаренные электроны. Образуются общие электронные пары. Электронная пара принадлежит в равной мере обоим атомам. Рассмотрим механизм образования молекулы хлора: Cl2 – кнс. Электронная схема образования молекулы Cl2:
Структурная формула молекулы Cl2: σ Cl – Cl, σ (p – p) - одинарная связь
Рассмотрим механизм образования молекулы кислорода: О2 – кнс. Электронная схема образования молекулы О2:
Структурная формула молекулы О2: σ О = О π В молекуле кратная, двойная связь: Одна σ (p – p)
и одна π (р – р)
Б) КОВАЛЕНТНАЯ ПОЛЯРНАЯ СВЯЗЬ (КПС) - образуют атомы разных неметаллов, отличающихся по значениям электроотрицательности (Например, HCl, H2O). Встречаются исключения, когда ковалентную связь образуют атом неметалла и металла! Например, AlCl3, разница в электроотрицательности ∆э.о.<1.7, т.е. ∆э.о. = 3,16 (Cl) – 1,61(Al) = 1,55 Электроотрицательность (ЭО) - это свойство атомов одного элемента притягивать к себе электроны от атомов других элементов. Самый электроотрицательный элемент – фтор F Электроотрицательность можно выразить количественно и выстроить элементы в ряд по ее возрастанию. Наиболее часто используют ряд электроотрицательности элементов, предложенный американским химиком Л. Полингом. Таблица. Электроотрицательности (ЭО) некоторых элементов (приведены в порядке возрастания ЭО).
Механизм образования связи. Каждый атом неметалла отдает в общее пользование другому атому свои наружные не спаренные электроны. Образуются общие электронные пары. Общая электронная пара смещена к более электроотрицательному элементу. Рассмотрим механизм образования молекулы хлороводорода: НCl – кпс. Электронная схема образования молекулы НCl: Структурная формула молекулы НCl: σ Н → Cl, σ (s – p) - одинарная связь σ, смещение электронной плотности в сторону более электроотрицательного атома хлора (→)
2. Сложные эфиры. Жиры
|