Нервная система. Розчин─ однорідна суміш 2-х і більшого числа молекулярних або йонних речовин, компоненти не можна відрізнити неозброєним оком (гомогенна системаРозчин─ однорідна суміш 2-х і більшого числа молекулярних або йонних речовин, компоненти не можна відрізнити неозброєним оком (гомогенна система, яка складається з 2-х і більше речовин). Класифікація: 1. За розчинником (водні і неводні) 2. За провідністю (електроліти і неелектроліти) 3. За класом розчиненої речовини (ро-ни кислот, основ і солей) 4. За концентрацією (насичені, ненасичені, пересичені) 5. За агрегтним станом (тверді, рідкі, газуваті) Розчинність ─; маса речовини, що розчиняється в 100 г розчинника при даних умовах. Конц. ─ безрозмірна або розмірна величина, яка виражає співвідношення компонентів у розчині. 1. масова частка то: 2. молярність розчину 3. моляльність розчину 4. нормальність розчину 5. титр ─ відношення маси розчиненої речовини в г до розчину в мл Н.Х. 24.Загальна характеристика та хімічні властивості елементів родини Феруму. До родини Феруму відносять: Ферум, Кобальт. Нікель. Атоме цих елементів на зовнішньому енергетичному рівні містять по 2 електрона, які вони віддають в хімічних реаціях. Але в утворенні хімічних зв”язків приймають участь також і електрони 3d-орбіталей другого зовні рівня. У своїх стійких сполуках ці елементи проявляють ступінь окиснення +2 і +3. Утворюють оксиди RO i R2O3. Їм відповідають гідроксиди складу R(OH)2 i R(OH)3. Для родини заліза характерною є властивість приєднувати нейтральні молекули. Залізо є більш реакційноздатним ніж кобальт і нікель. Кобальт і нікель при звичайній температурі стійкі до корозії на повітрі, у воді і різних розчинах. Розведені соляна і сульфатна кислоти легко розчиняють залізо і кобальт, а нікель тільки при нагріванні. Концентрована азотна кислота пасивує всі три метала. При нагріванні ці метали взаємодіють з киснем, парами води, галогенами, сіркою, фосфором, силіцієм, вугіллям і бором. Найбільш стійкими є сполуки заліза (ІІІ), кобальту (ІІ) і нікелю (ІІ). Метали родини заліза в ряді активностей знаходяться до водню. В природі поширені у вигляді оксидів, сульфідів, сульфатів, карбонатів. В стані вищіх ступенів окиснення проявляють окисні властивості.
Н.Х. 4.Окисно-відновні реакції та їх класифікація. Напрямок протікання ок.-в. реакцій. Ок.-в. реакції ─ ре-ції, в результаті проходження яких хімічний зв”язок між окремими атомами реагуючих речовин змінюється з неполярного на полярний (аобо навпаки), змінюється знак полярності на протилежний, змінюється кількість хімічних зв”язків і зарядженість; реакції, які проходять з перерозподілом хімічного зв”язку. Ступінь окислення─;умовний заряд, який мав би атом якби повністю втратив свої валентні електрони, або прийняв їх від відновника. Нульову ступінь окислення приписують простим речовинам. Окисники─;речовини, які містять в своєму складі атоми або іони, здатні зміщувати до себе частково або повністю приєднувати зв”язуючі електронні пари від інших атомів або іонів і тим самим відновлюватись тобто понижують свою ступінь окислення (O2,O3, H2O2,Hal2, KMnO4K2Cr2O7) Відновники─; речовини, які містять у своєму складі атоми, або йони, від яких частково зміщуються зв”язки пари, або повністю повністю переходять до інших атомів, які є окисниками і прицьому окислюються тобто збільшують свою ступінь окислення. (активні метали, SnO2, H2, CO,Na2SO3) Сила, яка регулює процес ок-ня-відн-ня називається окисно-відновним потенціалом., яку можна розрахувати:
Н.Х. 15. Загальна характеристика галогенів, їх фізичні та хім.властивості. соляна кислота та її солі. Hal: s2p5
Всі галогени відрізняються різким запахом, який спричиняє кашель і задуху. Хлор добре розчинний у воді.забарвлення стає більш темним зі збільшенням атомної маси. Неметали, але зі збільшенням атомної маси неметалеві властивості зменшуються і вже для йоду характерний металевий блиск. Всі галогени дуже активні (найактивніший F), так як мають малу енергію зв”язку. Мають велику реакційну спорідненість з Р і S (при взаємодії─ спалахують). Утворюють сполуки один з одним. Можлива взаємодія зі складними сполуками:
H2O+2Br2 (Br2O) +2HBr
Прирозчиненні хлорводню у воді одержується соляна кислота.
ця кислота є дуже активною. Fe+2HCl FeCl2 +H2
Н.Х. 14. гідроген, оксиген ─ фізичні і хімічні властивості. Методи добування ті застосування. Елементарний водень знаходиться в атмосфері на висоті більше 100 км;входить др складу Сонця, міжпланетних тіл і туманостей. Кисень ─ найпошириніший елемент: в повітрі, в воді, в гірських породах земної кори. У живій природі є важливим компонентом вуглеводнів та білкових сполук. Суміш водню з киснем в еквівалентному співвідношенні ─ грумуча суміш Процес взаємодії кисню з воднем є ланцюговим процесом:
О2+ Н• ОН• +О•
-Відновник -окисник -в/д з неметалами
-з металами з металами І і ІІ групи, лужні метали згорають гол. підгрупи утворює з утворенням оксидів і солеподібні гідриди, з пероксидів. Деякі метали бором─ легколеткі, з утворюють оксидну плівку. металами І-VIII груп, побічних підгр.─ мета- лоподібні гідриди. - одержання -в/д неблагородних ме- - розкладання кисневмісних талів(Zn,Fe,Mg) з кисло- солей (KMnO4,KClO3) тами не окисниками. –розклад оксидів(HgO) -в/д Al чи Si з лугами - електроліз водних розчинів -лужні метали з водою (NaOH,H2SO4) - використання в ленгмюрівській горіл- агрегатна зварка і різка, в ме- ці для зварки тугоплав- талургічній промисловості, в ких металіва. ракетах для окиснення палива
Н.Х. 23.Загальна характеристика та хімічні властивості елементів підгрупи Алюмінію. Всі елементи підгрупи алюмінію відносяться до р-елементів, їх атоми на зовнішньому енергетичному рівні містять по три електрона. Всі елементи тривалентні, але із збільшенням атомної маси набуває значення валентність рівна 1 (ТІ переважно одновалентний). Із збільшенням маси зростають металеві властивості. Сам Алюміній важається нетиповим металом ─ його гідроксид проявляє амфотерні властивості. Всі елементи підгрупи Алюміеію утворюють оксиди складу R2O3, їм відповідають гідроксиди R(OH)3, у водних розчинах можуть знаходитись у вигляді гідратованих йонів R3+. Найбільше значення із даної гарупи має алюміній. Елементи підгрупи Алюмінію хімічно активні, вони реагують з кислотами, лугами, галогенами. Алюміній і галій захищені невидимою оксидною плівкою, в той час як телур руйнується при дії вологого повітря 9зберігання під шаром гасу). Солі даних елементів в більшості випадків гідролізюють, стійкі тількі солі одновалентного телуру.
Н.Х. 16. загальна характеристика елементів підгрупи сульфуру. Сульфатна кислота. Зовнішній електричний шар: s2p4, всі крім оксигену мають вільний d-підрівень. Забарвлення неметалевих модифікацій темнішає зі збільшенням атомної маси. Кислотний характер оксидів зменшується із зб.ат. маси.Спорідненість до водню зменшується із зб.ат.маси, а до кисню збільшується. Всі халькогени мають сполуки з воднем. Всі крім кисню проявляють такі ступені окислення: +6,+4,+2,0,-2 (кисень тільки 0 і –2). S і Se мають алотропні кристалічні модифікації. O і S ─ ізолятори, Se і Te─ напівпровідники,Po─ типовий метал. Se і Te використовуються в електричній техніці як випрямляч електричного струму, для синтезу селенідів і телуридів. Po вик.для свічок моторів внутрішньго згорання; в ядерній фізиці. S ─ вулканізація гуми, проти шкіряних захворювань, проти шкідників в с/г. Сульфатна кислота ─ безбарвна масляниста рідина, утворює гідрати з 1,2,3,4,6,8 молекулами води. Перебуває в стані рівноваги:
Zn+H2SO4(розв.) ZnSO4+ Н2
Н.Х. 10.Валентність елементів. Валентність ─ здатність(міра здатності) елемента до утворення хімічних зв’язків, або хімічних сполук. Атоми елементів здатні віддавати, приєднувати електрони або утворювати спільні електронні пари. Електрони, які приймають участь в утворенні хімічного зв’язку називаються валентними. Це найслабше зв”язані електрони. У хімічних елементів загальна кількість валентних електронів в атомі, як правило рівне номеру групи періодичної системи (наприклад атом сірки елемент VI групи, містить 16 електронів, з яких 6 є валентними). До валентних електронів перш за все відносять електрони зовнішніх незакінчених рівнів.однак валентними можуть бути і електрони другого з зовні рівня (наприклад у d-елементів), а також третього з зовні рівня (у f-елементів). Валентність вимірюється числом ковалентних зв”язків, не можна говорити про валентність атомів в сполуках, в яких відсутній ковалентний зв”язок, в таких випадках говорять про ступінь окиснення. За формулами більшості неорганічних сполук можна судити лише про ступінь окиснення, а не про їх валентність. Супінь окиснення ─ умовний заряд, який мав би атом, якби повністю втратив свої валентні електрони, або прийняв їх Н.Х. 17. Загальна характеристика елементів головної підгрупи V групи. Сполуки нітрогену з металами та неметалами. Нітратна та нітритна кислоти. Із збільшенням атомної маси посилюється металевий характер. Із зб.ат.маси послаблюється кислотний характер оксидів. Гідроксиди в пятивалентному стані мають кислотний характер.
Із збільшенням атомної маси рівновага зміщується вправо.
ЕН3 +Н+ ЕН4+
Нітроген реакційно неактивний(висока прочність молекули). Хімічно активізується деякими перехідними металами. Аміак─безбарвний газ з різким запахом. Окислюється киснем без катализатора(з утворенням N2 і води) і з каталізатором(NO і вода), з йоними металів утворює аміачні комплекси, з активними металами утв.аміди, з кислотами солі амонію.нітриди металів од.з амідів:
розрізняють солеутворюючі(І-ІІІ групи), леткі(головна пдгрупа IV-VII групи), металоподібні(побічна підгрупа IV-VIII), алмазоподібні(B,Si,P). Оксиди: солеутворюючі(N2O3 i N2O5) і несолеутворюючі(N2O, NO, NO2─N2O4) Нітратна кислота:
З сульфатною кислотою утв. нітруючу суміш, з соляною ─ царську водку. Є сильним окисником, з металами в/д без виділення водню. Використовується для одержання нітратів, для нітрування органічних сполук, для обробки металів. Нітритна кислота─ слабка к-та, існує тільки в сильно розведених розчинах.
Н.Х. 18. Найважливіщі сполуки фосфору. Фосфорна к-та. В природі зустрічається майже завжди у вигляді солей фосфорної кислоти: фосфорит(Са3(РО4)2), гідроксилапатит (3Са3(РО4)2·Са(ОН)2), фторопатит(3Са3(РО4)2·СаF2) та ін. Для фосфору найбільш характерний ступень окиснення +5. Оксиди. Фосфор утворює декілька оксидів. Найважливіші це Р4О6 і Р4О10 (часто записують в скороченому варіанті: Р2О3 і Р2О5 ). Оксид фосфору (ІІІ) ─ воскоподібна кристалічна маса, одержується спалюванням фосфору при недостачі кисню. Сильний віднивник. Отрута. Оксид фосфору (V) ─ білий гігроскопічний порошок, одержується при горінні фосфору у надлишку кисню. Енергічно взаємодіє з водою, віднімає воду від інших сполук. використовіється як осушувач газів і рідин. Кислоти.. Оксид фосфору (V) при взаємодії з водою утворює триметафосфорну кислоту Н3(РО3)3 (скорочено─ НРО3), при кип”ятінні якої з надлишком води утворюється фосфорна кислота Н3РО4; при нагріванні Н3РО4 утворюється дифосфорна кислота Н4Р2О7. Найбільше практичне значення має фосфорна кислота, т.я.її солі─ фосфати використовують в якості добрив. Фосфорна кислота не є окисником і не розкладається при нагріванні. В промисловості одержується двома способами.
сульфат кальцію випадає у вигляді осаду, а кислота залишається в розчині. Таку кислоту використовують на одержання добрив. 2. Термічний. Спочатку одержують фосфор (відновленням природного фосфору в електропечи). Після цього його окислюють до Р4О10, а останій сполучають з водою і одержують чисту кислоту (80%). Солі фосфатної кислоти. Т.я.фосфатна кислота є трьохосновною, то вона утворює солі трьох типів: фосфати, гідрофосфати, дигідрофосфати. Всі фосфати лужних металів і амонію розчинні у воді, із кальцієвих солей у воді розчинні лише дигідрофосфат. Добрива. Фосфорні добрива─ це кальцієві і амонійні солі фосфорної кислоти. Розрізняють такі фосфорні добрива: фосфоритна мука (тонко помолоті фосфорити, містить головним чином Са3(РО4)2), простий суперфосфат (містить Са(Н2РО4)2 і Са SO4), двойний суперфосфат (Са(Н2РО4)2), преципітат (СаНРО4·2Н2О), косна мука (одержується перероботкою костей домашніх тварин, містить Са3(РО4)2), амофос(містить солі NH4Н2РО4 і (NН4)2НРО4).
Н.Х. 1.Основні стехіометричні закони хімії стехіометрія─ розділ хімії, в якому розглядаються масові і об’ємні відношення між реагуючими речовинами. До основних законів стехіометрії відносять: 1. закон збереження мас речовин 2. закон сталості складу 3. закон еквівалентів 4. закон об’ємних відношень 5. закон Авогадро. Закон збереження мас речовин вперше сформульований Ломоносовим: маса речовин, що вступають в хімічну реакцію, дорівнює масі речовин, що утворюються в результаті реакції. Закон сталості складу вперше сформулював Пруст:будь-яка речовина незалежно від способу добування завжди має сталий якісний і кількісний склад. Розвиток хімії показав, що крім речовин сталого складу (дальтонідів) існують сполуки змінного складу (бертоліди), у зв”язку з цим існує сучасна формуліровка даного закону: склад сполук молекулярної будови, тобто тих, що складаються з молекул, є сталим і не залежить від способу одержання. Склад сполук з не молекулярною будовою (атомною, йонною, металевою рещіткою) не є сталим і залежить від умов одержання. Закон еквівалентів відкритий Ріхтером:речовини взаємодіють між собою в кількостях, пропорційних їх хімічним еквівалентам. Закон об”ємних відношень встановлений Гей-Люссаком: об”єми газів, що вступають в реакцію при однакових умовах відносяться один до одного як прості цілі числа (коефіцієнти). Закон Авогадро: в рівних об”ємах різних газів при однакових умовах міститься однакова кількість молекул. При нормальних умовах 1 моль газу займає об”єм 22,4 л і містить 6,02·1023 молекул.
Н.Х. 9.Хімічний символ елементу і хімічна формула. Елементи прийнято позначати хімічними знаками (символами). Символ елементу складається з першої або першої і одної з наступних літер латинської назви елементу. склад складних речовин позначається за допомогою хімічних формул (наприклад формула H2SO4 показує, що це сірчана кислота, 1 моль якої містить 2 моль атомів водню, 1 моль атомів сірки і 4 моль атомів кисню).формулами позначають і молекули простих речовин, якщо відомо із скількох атомів складається молекула. Однак якщо речовина має атомну або металеву структуру або не відомий атомний склад молекули, то його зображають хімічним знаком елементу (наприклад Al, C, Fe). Хімічну формулу речовини можна встановити за результатами аналізу її складу. Існують такі типи хімічних формул: 1. молекулярна формула (відображає справжнє число атомів) 2. емпірична (відносне число атомів) 3. графічна (вказує порядок сполучення атомів у молекулі) 4. структурна (послідовність і порядок розміщення ат.) За допомогою хімічних формул можна розрахувати масові частки кожної складової, відношення між різними складивими, відносну молекулярну масу.
Н.Х. 6.Основні класи неорганічних сполук. До основних класів неорганічних сполук відносять: оксиди, кислоти, основи, солі. Оксидами називають складні речовини, що складаються з двох елементів, один з яких є кисень. Оксиди поділяються на ссновні, кислотні, амфотерні. Оксиди одержуються при горінні простих і складних сполук, при розкладанні деяких кисневмісних сполук.
Кислотні оксиди взаємодіють з лагами, основні з кислотами, амфотерні можуть взаємодіяти як з кислотами так і з лугами. Крім цього кислотні і основні оксиди можуть взаємодіяти між собою, утворюючі солі. Деякі оксиди взаємодіють з водою:
CaO+CO2 CaCO3
Кислоти взаємодіють з металами (що стоять в ряді активносей до водню), утворюючи солі, взаємодіють з основними оксидами, основами і солями
Основи ─ з точки зору ТЕД це сполуки, які дисоціюють з утворенням ОН─ групи. Розчинні у воді основи (луги) одержують взаємодією основних оксидів з водою, не розчинні основи одержуються не прямим методом: дією лугів на водні розчини відповідних солей:
Основи взаємодіють з кислотами, кислотними оксидами і солями:
Ca(OH)2+CO2 CaCO3+H2O
Генетичний зв”язрк між даними класами можна показати наступним чином: Оксиди Основні Кислотні
Солі
Н.Х. 11.Періодичний закон і періодична система елементів Закон: ластивостіхімічних елементів, а також форми і властивості єлементів знаходяться вперіодичній залежності від заряду ядер їх атомів. Теорія будови атомівпояснює періодичну зміну властивостей елементів. Збільшення додатніх зарядів атомних ядер від 1 до 107 зумовлює періодичне повторення будови зовнішнього енергетичного рівня. Так як властивості елементів залежать від числа алектронів на зовнішньому рівні, то і вони періодично повторюються. В малих періодах з ростом додатнього заряду ядер атома збільшується число електронів на зовнішньому рівні, що пояснюється зміною властивостей елементів (на початку періода знаходиться метал, потім послаблюються металеві властивості і посилюються неметалеві). У великих періодах із збільшенням заряду ядра заповнення рівнів електронами відбувається скланіше, що пояснює і більш складну зміну властивостей елементу в порівнянні з елементами малих періодів. У світлі вчення про будову атомів стає зрозумілим поділ всіх елементів на сім періодів. Номер періоду співпадає з числом енергетичних рівнів атомів, що заповнюються електронами. Тому s-елементи існують в усіх періодах, p-елементи─ в другому і наступних, d-елементи─ в четвертому і наступних, f-елементи в шостому і сьомому. Легко пояснити і поділ груп на підгрупи, що зумовлене різним заповненням електронами енергетичних рівнів. У елементів головних підгруп заповнюються або s-підрівні, або p-підрівні зовнішніх рівнів. У елементів побічної підгрупи заповнюється d-підрівень другого з зовні рівня, у лантаноїдів і актиноїдів заповнюються відповідно 4f- і 5f-підрівні. Таким чином в групи з”єднані елементи, атоми яких мають подібну будову зовнішнього електроного рівня. Номер групи, як правило, вказує на кількість валентних електронів Всі елементи ПС можна поділи на s-, p-,d- і f-елементи. Крім того за хімічними властивостями розрізняють метали, неметили і перехідні елементи. Н.Х. 21.Метали, їх розташування в періодичній системі. Хімічні властивості. Якщо в періодичній системі елементів провести діагональ від берілію до астату, то зліва знизу від діагоналі знаходяться елементи─ метали (до них також відносяться елементи побічних груп). Найбільш типові метали знаходяться на початку періодів (починаючи з другого). Таким чином, із 107 елементів 85 є металами. Для всіх металів характерний металевий блиск і непрозорість, метали мають хорошу електричну повідність і теплопровідність.
Метали здатні витісньти менш активні метали з їх солей:
Таким чином, відношення металів до наметалів, кислотам, розчинам солей меншактивних металів, до води і лугів підтверджує їх головну хімічну властивість ─ відновну. Метали можуть утворювати хімічні сполуки між собою ─ інтерметаліди(Na2Sb, Ca3Sb2). Хімічний зв”язок в інтерметалідах переважно металевий. По зовнішньому вигляду вони схожі на метали.
Н.Х. 12.Основні типи хімічних зв’язків у сполуках. МВЗ, ММО. Хімічний зв”язок, що утворюється електроними парами наз. ковалентним. це двухелектронний і двуцентровий зв”язок. Сполуки з ковалентним зв”язком називаються гомеополярними або атомними. Розрізняють неполярний і полярний ковалентний зв”язок. У випадку неполярного ков.зв.електрона хмара зв”язку, розповсюджується в просторі симетрично відносно ядер обох атомів (О2, Н2, та ін.). У випадку полярного ков.зв.електрона хмара зв”язку зміщена до атому з більшою відносною електронегативностю(Н2О). Ковалентний зв”язок утворюється не тільки за рахунок перекривання одноелектроних хмар, ─ це обміний механізм утворення ковалентного зв”язку. Можливий і інший механізм її утворення ─ донорно-акцепторний. В цьому випадку зв”язок виникає за рахунок двуелектронної хмари одного атома і вільної орбіталі іншого атома (NH4+). Хімічний зв”язок між йонами, що зумовлена електростатичним притяганням, наз. йонним зв”язком. Сполуки, які утворені шляхом притягання йонів, наз.гетерополярними або йоними. Йонні сполуки утворюють атоми елементів, що різко відрізняються електронегативностями. В механізмі виникнення ковалентно-неполярного, ковалентно-полярного і йоного зв”язку нема принципової різниці, вони відрізняються лише ступенем поляризації. Якщо різниця електронегативностей (ΔХ) більша або рівна 2 сполука вважається йонною (CsF має гранично велике значення ΔХ=3,24), при ΔХ=0 ─ ковалентно-неполярний, все інше ковалентно-полярний зв”язок. Металевий зв., що існує між йонами металів і здійснюється за допомогою відносно вільних електронів. Атоми здатні віддавати електрони при цьму перетворюючись на йони, вільні електрони при стикані з йонами, перетворюють його на атом. Водневий зв. ─зв”язок між атомами водню однієї молекули і сильно електронегативним елементом іншої молекули. Метод валентних зв”язків (МВЗ) основні положення: 1. одиничний хімічний зв”язок утворюють два електрона з різними спінами, що належать різним атомам. При цьому відбувається перекривання хвильвих функцій електронів і між атомами виникає зона із значною електронною густиною. Це призводить до зменшення потенційної еенргії, тобто до утворення зв”язку. 2. Зв”язок знаходиться в тому напрямку, в якому можливість перекривання хвильвих функцій електронів, утворюючих зв”язок, найбільша. 3. Із двох орбіталей атома найбільш міцний зв”язок утворює та, яка сильніше перекривається орбіталлю іншого атома. Метод молекулярних орбыталей (ММО). Для деяких молекул в утворенні хімічних зв”язків певну роль грають не електронні пари, а окремі електрони (наприклад йонизована молекула водню Н2+). В багатьох багатоатомних часточках є неспарені електрони (наприклад вільні радикали). Ці факти, не пояснені МВЗ, добре пояснюються ММО. Якщо в МВЗ використовується хвильова функція, що описує рух двох електронів в молекулі Н2, то ММО виходить з хвильвих функцій окремих електронів. Таким чином вважається, що кожен електрон в молекулі знаходиться на певній молекулярній орбіталі, що описується відповідною хвильвою функцією. Н.Х. 13.Загальна характеристика неметалів. Для неметалів швидше характерні відміності, ніж подібність властивостей. Щоб виявити властивості, характерні для всіх неметалів, треба перш за все звернути увагу на їх знаходження в ПС елементів Меделеєва і визначити число електронівна зовнішньому енергетичному рівні атомів. Неметали восновному знаходяться в кінці малих і великих періодів, а число зовнішніх електронів у їх атомів, як і у всіх атомів елементів головних підгруп, рівне номеругрупи. Можливість приєднувати електрони в періоді збільшується із приближенням до благородного газу, а в групі ─ по мірі зменшення радіусу атома. Для завершення зовнішніх електроних рівнів атоми неметалів приєдують електрони і є окисниками. Активніше за всіх приєднує електрон атом фтору. У атомів інших елементів зменшення можливості приєднувати електрони знаходиться у відповідності із зменшенням значень електронегативності. При взаємодії з металами, типові неметали утворюють сполуки із йоним зв”язком. В певних умовах неметали взаємодіють між собою, утворюючи сполуки з ковалентним зв”язком (полярні і неполярні ─ Н2О, С6Н6). З воднем неметали утворюють леткі сполуки (Н2S, HF). При розчиненні у воді водневі сполуки галогенів, сірки, селена і телуру утворюють кислоти тієї ж формули, що і самі водневі сполуки. При розчиненні у воді аміаку утворюється аміачна вода (зазвичай позначається формулою NH4OH). З киснем неметали утворюють кислотні оксиди. В одних оксидах вони проявляють максимальну ступінь окиснення, рівну номеру групи (SO3, N2O5), в інших ─ низьку (SO2, N2O3). Кислотним оксидам відповідають кислоти, із двох кисневмісних кислот одного неметала сильніша та, в якій він проявляє більш високий ступень окисненя. Атоми благородних газів на зовнішньому рівні містять по 8 електронів (у гелію 2). Раніше вважалось, що такі атоми не можуть ні віддавати електрони, ні приєднувати їх, ні ктворювати спільні електроні пари. Але пізніше було одержано перешу хімічну сполуку благородного газу ─ тетрафторид ксенону, після чого хімія благородних газів почала розвиватись швидкими темпами. Н.Х. 22.Характеристика та хімічні властивості металів І і ІІ груп. Елементи І групи головної підгрупи характеризуються відносно великим атомним об”ємом, низькою густиною, сильною основністю, низьким потенціалом іонізації, розчинністю в рідкому аміаку. Метали ІІ групи мають менші атомні об”єми, більш високий потенціал іонізації, більшу густину, в меншій мірі розчинні в рідкому аміаку. Метали І і ІІ груп є дуже реакційноздатними, з воднем утворюють солеподібні гідриди (МН і МН2), а також здатні до взаємодії з різними неметалами. Метали І і ІІ групи (крім берілію) взаємодіють з водою. Метали І і ІІ груп легко віддають валентний електрон і переходять в додатньо заряджені йони, є сильними відновниками. На повітрі ці метали окислюються коснем повітря, тому їх зберігають під шаром гасу. Метали І групи згорають на повітрі, як продукти згорання найчастіше утворюються пероксиди. Гідрогсиди металівІ і ІІ груп насять основний характер (гідроксиди металів І групи, а також Ва і частково Са розчинні у воді). Ці метали легко витісняють водень при взаємодії з кислотами. Солі металів І групи як правило розчинні у воді.
Н.Х. 19.Загальна характеристика елементів IV групи головної підгрупи. Карбон, його фізичні та хімічні властивості. Неорганічні сполуки карбону. В підгрупу вуглецю входять вуглець, кремній, германій, олово і свинець. Атоми цих елементів містять по 4 електрона на зовнішньому рівні ─ns2np2.в незбудженому стані атоми містять 2 неспарених електрона, при переході у збуджений стан проявляють валентність 4. В сполуках проявляють ступень окисненя +4,─4, а токож +2, остання при збільшенні ядра стає більш характерною. Ступеньокиснення ─4 в послідовності С─Pb стає все менш характерною. Елементи підгрупи вуглецю утворюють оксиди загальної формули RO2 i RO, а водневі сполуки ─ формули RH4. Гідрати вищіх оксидів вуглецю і кремнію проявляють кислотній характер, гідрати інших елеменів амфотерні. Від вуглецю до свинцю зменшується прочність водневих сполук RH4: СН4─ прочна сполука, а PbН4 у вільному вигляді не виділено. В підгрупі із збільшенням порядкового номеру неметалеві властивості послаблюються, а металеві
|

 , якщо 2 компонента,
, якщо 2 компонента,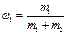
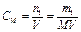


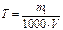

 F-, Cl-, Br-, J- збільшення йонного радіуса.
F-, Cl-, Br-, J- збільшення йонного радіуса. СН4+4Cl2 CCl4 +4HCl
СН4+4Cl2 CCl4 +4HCl NH3+3Cl2 NCl3 +3HCl
NH3+3Cl2 NCl3 +3HCl Всі галогени сполучаються з воднем, найлегше сполучаеться фтор(навіть при ─250°С реагує з вибухом)
Всі галогени сполучаються з воднем, найлегше сполучаеться фтор(навіть при ─250°С реагує з вибухом) 2NaCl+H2SO4 Na2SO4 + 2HCl
2NaCl+H2SO4 Na2SO4 + 2HCl 2Cu+O2+4HCl 2CuCl2 +2H2O
2Cu+O2+4HCl 2CuCl2 +2H2O 2Н2 +О2 2Н2О
2Н2 +О2 2Н2О О• +Н2 ОН•+ Н•
О• +Н2 ОН•+ Н• 3Н2+N2 2NH3 підтримує горіння
3Н2+N2 2NH3 підтримує горіння
 H2+Cl2 2HCl S+O2 SO2
H2+Cl2 2HCl S+O2 SO2
 H2SO4+ SO3 H2S2О7
H2SO4+ SO3 H2S2О7 С6Н12О6+6H2SO4 6С+6 H2SO4·H2O
С6Н12О6+6H2SO4 6С+6 H2SO4·H2O 3Zn +4H2SO4(конц) 3ZnSO4+ S +4H2O
3Zn +4H2SO4(конц) 3ZnSO4+ S +4H2O Сульфатна кислота один із найважливіших полуфабрикатів хімічної промисловості(виробництво добрив, різних солей, вибухових речовин, барвників).
Сульфатна кислота один із найважливіших полуфабрикатів хімічної промисловості(виробництво добрив, різних солей, вибухових речовин, барвників).

 Водневі сполуки:
Водневі сполуки: Для N2 рівновага зміщена впріво вже в нейтральномі розчині, а для As ─ вліво навіть при великих концентраціях йонів Н+.
Для N2 рівновага зміщена впріво вже в нейтральномі розчині, а для As ─ вліво навіть при великих концентраціях йонів Н+. 3Mg+6NH3 3Mg(NH2)2+3H2 амід
3Mg+6NH3 3Mg(NH2)2+3H2 амід 3Mg(NH2)2 3 MgNH + 3NH3 імід
3Mg(NH2)2 3 MgNH + 3NH3 імід 3MgNH Mg3N2+NH3 нітрид
3MgNH Mg3N2+NH3 нітрид NaNO3+H2SO4(конц.) НNO3+ NaHSO4
NaNO3+H2SO4(конц.) НNO3+ NaHSO4
 3НNO2 НNO3+2NO+H2О
3НNO2 НNO3+2NO+H2О одержання:AgNO2+HCl AgCl+HNO2
одержання:AgNO2+HCl AgCl+HNO2 1. Екстракційний. Помілений фосфат кальцію обробляють сірчаною кислотою: Са3(РО4)2+3Н2SO4 2Н3РО4+3Са SO4
1. Екстракційний. Помілений фосфат кальцію обробляють сірчаною кислотою: Са3(РО4)2+3Н2SO4 2Н3РО4+3Са SO4
 CaCO3 CaO+CO2
CaCO3 CaO+CO2 FeO+ H2SO4 FeSO4+H2O;
FeO+ H2SO4 FeSO4+H2O; SO3+2NaOH Na2 SO4+H2O
SO3+2NaOH Na2 SO4+H2O H2SO4+CuO CuSO4+H2O;
H2SO4+CuO CuSO4+H2O; H2SO4+2KOH K2SO4+2H2O
H2SO4+2KOH K2SO4+2H2O 2HCl+Fe FeCl2+H2
2HCl+Fe FeCl2+H2 2Na+2H2O 2NaOH
2Na+2H2O 2NaOH Амфотерні основи взаємодіють як з розчинами кислот так і з розчинами лугів:
Амфотерні основи взаємодіють як з розчинами кислот так і з розчинами лугів: Солі─; з точки зору ТЕД це електроліти, які дисоціюють з утворенням йонів двох видів: катіони металів (і амонію) і аніони кислотних залишків. Одержують солі при взаємодії кислоти з основою, основним оксидом, з солями, металами, основи з кислотним оксидом, лугу з солями, основних оксидів з кислотними, металів з солями, при взаємодії двох солей: Na2 SO4+BaCl Ba2SO4+2NaCl
Солі─; з точки зору ТЕД це електроліти, які дисоціюють з утворенням йонів двох видів: катіони металів (і амонію) і аніони кислотних залишків. Одержують солі при взаємодії кислоти з основою, основним оксидом, з солями, металами, основи з кислотним оксидом, лугу з солями, основних оксидів з кислотними, металів з солями, при взаємодії двох солей: Na2 SO4+BaCl Ba2SO4+2NaCl



 Основи кислоти
Основи кислоти Ni+CuSO4 NiSO4+Cu
Ni+CuSO4 NiSO4+Cu Активні метали взаємодіють з водою:2Na+2H2O NaOH+H2
Активні метали взаємодіють з водою:2Na+2H2O NaOH+H2


