Понижение температуры замерзания и повышение температуры кипения растворов. Второй закон РауляРастворы замерзают при более низкой температуре, а кипят при более высокой температуре, чем чистый растворитель. Понижение температуры замерзания и повышение температуры кипения раствора пропорционально моляльной концентрации растворенного вещества (второй закон Рауля), т.е. ∆toзам=КК∙С; ∆toкип=КЭ∙С; где ∆toзам – понижение температуры замерзания раствора; ∆toкип – повышение температуры кипения раствора; КК – криоскопическая константа; КЭ – эбуллиоскопическая константа; С – моляльная концентрация растворенного вещества. Если «m» граммов неэлектролита, имеющего молярную массу М, растворены в m граммах растворителя, то закон Рауля для неэлектролитов можно записать в следующем виде:
Указанные формулы позволяют находить молярную массу растворенного вещества. Пример 1. Определение температуры кипения и замерзания раствора неэлектролита. Определите температуру кипения и замерзания раствора, содержащего 1г нитробензола С6Н5NO2 в 10г бензола. Эбуллиоскопическая и криоскопическая константы бензола соответственно равны 2,57 и 51оС. Решение. По закону Рауля следует, что
Тогда
Температура кипения раствора: Пример 2. Вычисление молярной массы неэлектролита по повышению температуры кипения раствора. Раствор камфоры массой 0,552г в 17г эфира кипит при температуре на 0,461оС выше, чем чистый эфир. Эбуллиоскопическая константа эфира 2,16оС. Определите молярную массу камфоры. Решение. Молярную массу камфоры определяем пользуясь соотношением:
Молярная масса камфоры равна 155,14г∙моль-1. Пример 3. Вычисление криоскопической константы растворителя. Вычислите криоскопическую константу воды, если водный раствор этилового спирта (ω=0,113) замерзает при -5оС. Решение. Молярная масса этилового спирта равна 46,07. Из соотношения, приведенного в примере 1, получаем:
Криоскопическая константа воды КК = 1,81оС. Пример 4. Вычислите температуры кристаллизации и кипения 2% -ного водного раствора глюкозы. Решение. По закону Рауля понижение температуры кристаллизации и повышение температуры кипения раствора (∆Т) по сравнению с температурами кристаллизации и кипения растворителя выражаются уравнением
где К — криоскопическая или эбуллиоскопическая константа. Для воды они соответственно равны 1,86 и 0,52°; т и М — соответственно масса растворенного вещества и его молярная масса; т1 — масса растворителя. Понижение температуры кристаллизации 2%-ного раствора С6Н12О6 находим по формуле (1):
Вода кристаллизуется при 0С, следовательно, температура кристаллизации раствора 0 - 0,21 = - 0,21 С. По формуле (1) находим и повышение температуры кипения – 2%-ного раствора:
Вода кипит при 100°С, следовательно, температура кипения этого раствора 100 + 0,06 = 100,06°С. Пример 5. Раствор, содержащий 1,22 г бензойной кислоты С6Н5СООН в 100 г сероуглерода, кипит при 46,529°С. Температура кипения сероуглерода 46,3°С. Вычислите эбуллиоскопическую константу сероуглерода. Решение. Повышение температуры кипения ДТ = 46,529 - 46,3 = = 0,229°. Молярная масса бензойной кислоты 122 г/моль. По формуле (1) находим эбуллиоскопическую константу:
Пример 6. Раствор, содержащий 11,04 г глицерина в 800 г воды, кристаллизуется при -0,279°С. Вычислите молярную массу глицерина. Решение. Температура кристаллизации чистой воды 0 0С, следовательно, понижение температуры кристаллизации ∆Т=0 – (-0,279)=0,2790С. Масса глицерина т (г), приходящаяся на 1000 г воды, равна:
Подставляя в уравнение
числовые значения, вычисляем молярную массу глицерина:
Пример 7. Вычислите массовую долю (%) водного раствора мочевины (NH2)2CO, зная, что температура кристаллизации этого раствора равна -0,4650С. Решение: Температура кристаллизации чистой воды 00С, следовательно, ∆Т = 0 – (-0,465) = + 0,4650. Молярная масса мочевины 60 г/моль. Находим массу m (г) растворенного вещества, приходящуюся на 1000г воды, по формуле (2):
Общая масса раствора, содержащего 15г мочевины, составляет 1000+15=1015г. Процентное содержание мочевины в данном растворе находим из соотношения В 1015г раствора – 15г вещества В 100 г раствора – х х = 1,48%
|

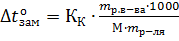 и
и 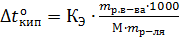

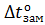 равна
равна 

 .
.
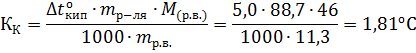
 (1)
(1)



 (2)
(2)




