Алгоритм определения состава атома.1. Записать знак химического элемента, указать индексы. Нижний индекс (заряд ядра) определить по порядковому номеру химического элемента в Периодической системе, верхний индекс (массовое число) определить по относительной атомной массе химического элемента – 2. По заряду ядра (нижний индекс) определить количество протонов – 3. Количество нейтронов определить по разности между массовым числом и количеством протонов (верхним и нижним индексом) – 4. По заряду ядра (нижний индекс) определить количество электронов –
Ядра с большим количеством протонов (свыше 83) неустойчивы. Они распадаются на меньшие ядра, отдельные частицы. Этот процесс называется радиоактивным распадом. Неустойчивость больших ядер – причина того, что в природе нет элементов с порядковыми номерами, превышающими 92. их атомы получены в лабораториях с использованием уникального оборудования, которое дает возможность фиксировать частицы, существующие доли секунды.
1. Атом состоит из ядра и электронов. 2. Ядро имеет положительный заряд; в нем содержатся протоны и нейтроны, в ядре сосредоточена почти вся масс атома. 3. Количество протонов и нейтронов в атоме одинаково, оно совпадает с порядковым номером элемента. 4. Количество нейтронов в ядре атома равно разности между массовым числом и количеством протонов. 5. Главная характеристика химического элемента – заряд ядра.
1. Интернетурок Становление в науке представлений о строении атома 2. Сайт ФЦИОР, информационный модуль Состав атомных ядер (последний кадр-интерактивное задание)
Исследования по определению массы и заряда ядра атомов различных элементов показали, что в природе встречаются атомы одного и того же элемента с одинаковым зарядом ядра, но имеющие при этом различную массу. Так были обнаружены атомы хлора с различными массовыми числами: атомы с массовым числом 35 (хлор-35) и атомы с массовым числом 37 (хлор-37), но с одним и тем же зарядом атомных ядер +17. Одинаковый заряд ядра свидетельствует о том, что атомы одного и того же элемента – хлора. Хлор-35 Хлор-37
Вам известно, что массовое число – это сумма протонов и нейтронов. так как число протонов в ядрах атомов одинаково и равно 17, то, следовательно, в ядрах одной из разновидностей атомов хлора содержится 18 нейтронов (35 – 17 = 18), а в ядрах другой – 20 нейтронов (37 – 17 = 20).
Изотопы одного и того же элемента имеют одинаковое число протонов и электронов, а отличаются друг от друга только числом нейтронов. Слово "изотоп" образовано от двух греческих слов: изос – один и топос – место. Изотопы занимают одно место (клетку) в Периодической системе химических элементов. Химические свойства изотопов одинаковы, а некоторые физические свойства незначительно отличаются. Всего известно более 2000 изотопов, из которых около 300 существуют в природе, а остальные получены искусственным путем. Например, в природе встречаются три изотопа кислорода: кислород-16 (16О), кислород-17 (17О) и кислород-18 (18О).
Таблица. Изотопы кислорода.
Массовые числа изотопов всегда выражаются целыми числами. Но в природе большинство элементов встречаются в природе в виде нескольких изотопов, а значение, приведенное в периодической системе, является средним, рассчитанным с учетом процентного содержания каждого изотопа в земной коре. Химические свойства изотопов одного и того же элемента совершенно одинаковы. Однако изотопы водорода сильно различаются по свойствам из-за резкого кратного увеличения их относительной атомной массы; им даже присвоены индивидуальные названия и химические знаки: протий –
Рис. Три изотопа водорода
Большинство видов атомов существуют вечно, т. е. их ядра не распадаются. Однако некоторые изотопы обладают способностью самопроизвольно превращаться в атомы других элементов, испуская электроны или ядра гелия. Способность ядер самопроизвольно распадаться называется радиоактивностью, а элементы, все изотопы которых неустойчивы и самопроизвольно распадаются, называют радиоактивными. Так, радиоактивными являются все элементы, следующие за висмутом в периодической системе. Радиоактивные изотопы бывают естественными и искусственными. Самый мощный источник естественных изотопов на Земле – урановые минералы, а наиболее распространенным изотопом элемента урана является уран-238 ( Свойства некоторых радиоактивных изотопов используют в различных областях науки и техники. Радиоактивные изотопы находят широкое применение в медицине. Для исследования функций печени, почек и других органов широко применяется радиоактивный изотоп иода, для лечения раковых заболеваний – радиоактивный изотоп кобальта-60. Радиоизотопы используют для выявления утечки веществ из накопительных баков и трубопроводов, например, в газонефтяной промышленности, для испытания износа двигателей в авиа- и машиностроении – для измерения толщины металлических листов, труб и стержней. Радиоактивный изотоп углерода-14 широко применяются в геологии, археологии, антропологии для датирования возраста образцов, имеющих возраст даже до 35 тыс. лет. Важной сферой применения радиоактивных изотопов является атомная энергетика. Во время распада неустойчивых ядер атомов возникает излучение, небольшие дозы которого приводят к серьезным заболеваниям, а высокие – к гибели всего живого. Поэтому работа с радиоактивными веществами требует особого внимания, осторожности и должна предусматривать защиту людей и окружающей среды от этого излучения.
1. Виды атомов одного химического элемента с различным количеством нейтронов называют изотопами. Изотопы (за исключением изотопов водорода) имеют одинаковые химические свойства. 2. Изотопы бывают стабильными и радиоактивными. Радиоактивные изотопы используют в различных областях науки, технике, в энергетике, медицине. 3. Радиоактивные вещества опасны для людей, всей живой природы.
1. Сайт ФЦИОР, информационный модуль Изотопы как разновидности атомов одного химического элемента кадры1-3
Атом состоит из положительно заряженного ядра и движущихся вокруг него отрицательно заряженных электронов, которые образуют электронную оболочку.
Рассмотрим, как распределяются электроны вокруг ядра атома. Условно можно представать, что электроны, образующие электронную оболочку атома, размещаются вокруг ядра электронными слоями (одни ближе к ядру, другие – дальше) и обладают различным запасом энергии. По мере удаления от ядра атома сила притяжения электрона к ядру уменьшается, а запас энергии увеличивается. Каждый слой состоит из электронов с близкими значениями энергии, поэтому слои электронов называют энергетическими уровнями.
Количество энергетических уровней, на которых располагаются электроны можно определить по номеру периода. Максимальное число электронов, которое могут находиться на том или ином энергетическом уровне определяется по формуле: N = 2 n 2, где N – максимальное число электронов на уровне; n –номер энергетического уровня. Следовательно, на первом энергетическом уровне (n = 1) может находиться не более двух электронов (2 · 12 = 2); на втором (n = 2) – не более восьми (2 · 22 = 8); на третьем (n = 3) – не более восьми (2 · 32 = 18) и т. д. Кроме того, установлено, что на внешнем энергетическом уровне может находиться не более 8 электронов. Электроны, которые находятся на внешнем энергетическом уровне, называются валентными. Количество валентных электронов равно номеру группы. Если энергетический уровень содержит максимально возможное число электронов, то его называют завершенным. Энергетические уровни, не содержащие максимального числа электронов, называют незавершенными. Электроны завершенных энергетических располагаются парами (спаренные электроны), а незавершенного – и парами, и по одному (неспаренные электроны). Число неспаренных электронов в атомах химических элементов главных подгрупп можно определить по формуле:
2. По порядковому номеру определить заряд ядра –
Классификация элементов на основе строения их атомов. На основе теории строения атомов предложено несколько способов классификации элементов. Один из них – классификация элементов по числу электронов на внешнем энергетическом уровне. По этому признаку различают две категории элементов.
1. Электроны вращаются вокруг ядра и распределяются по энергетическим уровням. 2. Каждый энергетический уровень вмещает определенное количество электронов, которое рассчитывается по формуле N = 2 n 2. 3. По количеству электронов на внешнем энергетическом уровне все химические элементы делятся на металлы и неметаллы.
Атомы большинства химических элементов не могут долго существовать поодиночке. Они соединяются с такими же или другими атомами и образуют различные соединения. Среди всех известных веществ лишь инертные газы: гелий, неон, аргон, криптон, ксенон и радон состоят из отдельных атомов. Долгое время ученым не удавалось осуществить химические реакции с участием инертных газов; их атомы «не хотели» соединятся с атомами других элементов. Причина химической пассивности этих веществ стала понятна позже, после открытия строения атомов.  ). Исключение – гелий (два электрона). Восемь электронов на внешнем уровне – предельное число для любого химического элемента, кроме водорода и гелия. Это наиболее энергетически устойчивое и выгодное состояние атома. Атомы всех остальных химических элементов стремятся приобрести электронную конфигурацию ближайшего благородного газа, т. е. перейти в наиболее устойчивое состояние. Такое стабильное состояние атомы приобретают, взаимодействуя между собой, в результате между ними образуется химическая связь. Этого можно достичь несколькими способами: переходом электронов от одного атома к другому или обобществлением неспаренных электронов. ). Исключение – гелий (два электрона). Восемь электронов на внешнем уровне – предельное число для любого химического элемента, кроме водорода и гелия. Это наиболее энергетически устойчивое и выгодное состояние атома. Атомы всех остальных химических элементов стремятся приобрести электронную конфигурацию ближайшего благородного газа, т. е. перейти в наиболее устойчивое состояние. Такое стабильное состояние атомы приобретают, взаимодействуя между собой, в результате между ними образуется химическая связь. Этого можно достичь несколькими способами: переходом электронов от одного атома к другому или обобществлением неспаренных электронов.
Способ образования химической связи зависит от разницы в электроотрицательности элементов.
Чем сильнее атомы притягивают электроны, тем больше, тем больше значение ЭО. Наибольшую электроотрицательность имеют атомы фтора (≈4), а наименьшую атомы франция (0,86). В периодах электроотрицательность атомов элементов возрастает с увеличением зарядов ядер атомов (т. е. слева направо), а в главных подгруппах – снизу вверх. Электроотрицательность атомов металлов меньше 1,8 – 2, а атомов неметаллов – больше 1,8 – 2. Таким образом, атомы металлов имеют тенденцию к отдаче электронов с внешнего уровня. И наоборот, тенденцию к принятию недостающих до завершения внешнего энергетического уровня имеют атомы элементов-неметаллов, элементы неметаллы могут и отдавать электроны. Таким образом, атом, соединяясь с другим атомом, может потерять или получить один или несколько электронов. При этом он становится положительно или отрицательно заряженной частицей – ионом.
Если атом теряет один электрон, то образуется ион с зарядом +1, а если присоединяет электрон, то заряд иона будет равен –1. В случае потери атомом или присоединения к нему двух электронов образуются ионы с зарядами соответственно +2 или –2.
Взаимодействие атомов металла и неметалла. Между атомами металла и неметалла значительная разница в электроотрицательности. Например, у атома натрия низкая электроотрицательность, а на внешнем энергетическом уровне всего один электрон. В химических реакциях эти атомы легко отдают валентные электроны и превращаются в положительные ионы с электронной конфигурацией инертного газа неона. Na – e- → Na+ У атома фтора высокая электроотрицательность, а на внешнем энергетическом уровне семь электронов (не хватает одного электрона до завершения уровня), поэтому атом фтора принимает электрон и превращается в отрицательный ион с конфигурацией инертного газа неона. F + e- → F – Положительные и отрицательные ионы притягиваются друг к другу.
Ионы притягиваются друг к другу тем сильнее, чем больше заряд каждой частицы и чем меньше расстояние между ними.
1. Наиболее устойчивая внешняя электронная конфигурация атома содержит восемь электронов (октет). 2. Атомы элементов-металлов способны отдавать валентные электроны и превращаться в положительные ионы, а атомы элементов-неметаллов – присоединять электроны и превращаться в отрицательные ионы. 3. Ионная связь – это притяжение между противоположно заряженными ионами.
1. Информационные модули ФЦИОР Электроотрицательность кадр 4, Образование ионной связи кадр 2, Ионы и ионная связь 2. Виртуальная лаборатория Конструктор анимаций "Схема образования ионной химической связи"
Соединяться могут и атомы неметаллов, одинаковые или разные. Между атомами одинаковых неметаллов разница в электроотрицательности равна 0, между атомами различных неметаллов незначительна. Поэтому, переход электронов от одного атома к другому невозможен и способ образования химической связи иной. Рассмотрим, как соединяются два атома водорода. Каждый атом имеет один электрон. При сближении двух атомов электрон каждого атома начинает притягиваться не только к своему ядру, но к ядру соседнего атома. С уменьшением расстояния между ними притяжение электронов каждого атома к ядру другого атома усиливается. При этом будет возрастать отталкивание между одноименно (положительно) заряженными ядрами атомов. Когда силы притягивания и отталкивания уравняются, атомы остановятся. Электроны станут общими и образуется молекула, состоящая из двух атомов водорода.
Образование молекулы водорода можно записать в виде схемы:

Атомы других неметаллов стремятся дополнить свой внешний энергетический уровень до 8 электронов. Составим схему образования связи в молекуле хлора. Атом хлора содержит на внешнем энергетическом уровне 7 электронов – три пары электронов и один неспаренный электрон. До завершения внешнего уровня атому фтора не хватает одного электрона, поэтому каждый из атомов предоставляет в общее пользование по одному неспаренному электрону, электроны становятся общими и образуют общую электронную пару:

Аналогично образуется химическая связь между различными атомами неметаллов, например, образование молекулы хлороводорода:

Таким образом, соединяться могут не только противоположно заряженные ионы, но и электронейтральные атомы – одинаковые или разные. Благодаря этому существуют вещества молекулярного и атомного строения.
1. Атомы неметаллов объединяют неспаренные электроны в общие электронные пары, принадлежащие одновременно обоим атомам, в результате образуются молекулы. 2. При образовании молекулы атомы стремятся к тому, чтобы на их внешнем электронном уровне было восемь электронов (для водорода – два электрона). 3. Химическую связь, образованную с помощью общих электронных пар называют ковалентной связью. 4. С помощью ковалентной связи образуются вещества молекулярного и атомного строения.
1. Сайт ФЦИОР, информационный модуль Образование молекул Кадр 1,2,3 2. Виртуальная лаборатория Конструктор анимаций " Механизм образования ковалентной связи" (образование молекулы водорода из атомов водорода)
Таким образом, вещества состоят из мельчайших частиц: атомов, ионов или молекул. В большинстве твердых веществ частицы располагаются упорядоченно, в строго определенных точках пространства. Такие вещества называют кристаллическими. Внутреннее строение кристаллических веществ описывают с помощью модели, название которой – кристаллическая решетка. Это схема или объемный макет размещения частиц в небольшой части кристалла. Исходя из такой модели, можно воспроизвести строение вещества в целом. Шарики в кристаллической решетке имитируют частицы вещества – ионы, атомы или молекулы. Они размещены в так называемых узлах кристаллической решетки.
Ионными называют кристаллические решетки, в узлах которых находятся ионы. Их образуют вещества с ионной связью. Например, кристалл поваренной соли построен из чередующихся положительных ионов натрия Na+ и отрицательных ионов хлора Cl-, образующих решетку в виде куба.
1. В твердом агрегатном состоянии большинство веществ имеет кристаллическое строение. 2. Внутреннее строение кристаллических веществ описывают с помощью модели – кристаллической решетки. 3. В зависимости от типа частиц, из которых состоит вещество выделяют ионную, атомную и молекулярную кристаллическую решетку
1. Сайт ФЦИОР, информационный модуль Типы кристаллических решеток кадр 2 (кадр 1 дополнительно)
|

 .
.
 , 15
, 15 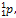 16
16 
 15 е-.
15 е-.


 8
8 


 ; дейтерий –
; дейтерий –  , или
, или  ; тритий –
; тритий –  , или
, или  .
. ). Открытию и изучению радиоактивных элементов посвятили свою жизнь супруги Мария Склодовская-Кюри и Пьер Кюри. Изучением свойств радиоактивных элементов занимается наука радиохимия.
). Открытию и изучению радиоактивных элементов посвятили свою жизнь супруги Мария Склодовская-Кюри и Пьер Кюри. Изучением свойств радиоактивных элементов занимается наука радиохимия.