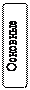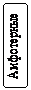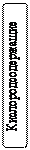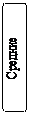Понятие о степени окисленияСтепень окисления – условный заряд атома в соединении, вычисленный, исходя из предположения, что оно состоит только из ионов. Степень окисления может иметь положительное, отрицательное и нулевое значение, которое выражают арабскими цифрами с соответствующим знаком и располагают справа от символа элемента. Например, Al2+3O3–2; Н20. При определении степени окисления учитывают следующие положения: 1. Алгебраическая сумма степеней окисления атомов в молекуле равна нулю, в сложном ионе – заряду иона. 2. Степень окисления гидроксильной группы равна «–1»(ОН –), водорода – «+1» (Н+), кислорода – «– 2» (O – 2) (за исключением водорода в составе гидридов металлов и кислорода в составе перекисей. Например, в гидриде водорода (NaH)степень окисления водорода равна 1 –, в перекиси водорода (Н2O2) степень окисления кислорода равна 1+. При записи формулы химического соединения на первое место ставят электроположительные элементы, располагая их по мере увеличения степени окисления, в конце – электроотрицательный. Например, Na+2O2–, H+2S6+O2–4.
Оксиды Оксидами называют бинарные (состоящие из двух элементов) соединения, в которых один из элементов – кислород, причем атомы кислорода не связаны между собой и находятся в степени окисления 2–. Оксиды бывают солеобразующие - им соответствуют соли, которые образуются при взаимодействии этих оксидов с кислотами и щелочами; и несолеобразующие (безразличные, индифферентные) им не соответствуют соли (N2O, NO, CO), обычно это соли неметаллов в низших степенях окисления. Солеобразующие оксиды по составу и химическим свойствам делятся на основные, кислотные и амфотерные. Основные – оксиды металлов в невысоких степенях окисления (1+ и 2+), которые реагируют с кислотами, образуя соли (К2О, MgO). Кислотные – оксиды неметаллов и оксиды металлов в высоких степенях окисления (больше 4+), которые реагируют со щелочами, образуя соли (СО2, Р2О5). Кислотные оксиды называют также ангидридами, так как при взаимодействии с водой они образуют соответствующие кислоты. Амфотерные оксиды образуют некоторые металлы, проявляющие степень окисления +2 (Be, Zn, Sn,Pb) и металлы, степень окисления которых +3, +4 (Al, Cr, Mn и др.). Понятие «амфотерность» означает двойственность свойств, т.е. способность проявлять свойства и основных и кислотных оксидов в зависимости от свойств химического «партнера». При этом, если «партнер» проявляет кислотные свойства, то реагирующий с ним амфотерный оксид выступает в противоположном качестве – в качестве основного оксида и наоборот. Номенклатура оксидов. Согласно международной номенклатуре названия оксидов составляют из слова «оксид» и русского названия элемента, образующего оксид, в родительном падеже.
Если элемент образует несколько оксидов, то после названия оксида в скобках указывается степень окисления этого элемента. Например, MgO – оксид магния; MnO2 – оксид марганца (IV); Mn2O7 – оксид марганца (VII). Реакции взаимодействия оксидов с кислотами, основаниями и водой приведены в табл. 3.3.1. Основные оксиды взаимодействуют с кислотными образуя соли: MgO + CO2 → MgCO3; Na2O + Cl2O7 → 2NaClO4. Получить оксиды можно несколькими способами. 1. Соединение простого вещества с кислородом (как правило, при нагревании): С + О2 = CO2; 2Mg + О2 = 2 MgO. 2. Термическое разложение соответствующих кислот, оснований, неустойчивых солей: Cu(OH)2 = CuO + H2O; H2SiO3 = SiO2 + H2O; CaCO3 = CaO + CO2; 2Pb(NO3)2 = 2PbO + 4NO2 + O2. 3. Действием кислоты или щелочи на соответствующую соль (если оксиду соответствует неустойчивая кислота или неустойчивое основание): Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑; (кислотный оксид); 2AgNO3 + 2NaOH = 2NaNO3 + H2O + Ag2O↓ (основный оксид).
|