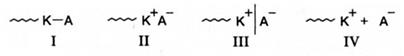Влияние растворителя и температуры
Роль растворителя в катионной полимеризации заключается, прежде всего, в его влиянии на степень разделенности ионных пар на концах растущих цепей. Существует четыре типа активных центров в катионной полимеризации, которые принято характеризовать как ковалентносвязанные (I), контактные (II), разделенные (III) ионные пары и свободный карбкатион (IV):
В большинстве случаев при полимеризации существуют активные центры II - IV, находящиеся в равновесии друг с другом. Относительное содержание свободных ионов не превышает нескольких процентов, однако, они оказывают большое влияние на скорость полимеризации, поскольку реакционная способность активных центров возрастает в ряду I<<II<<III<IV. Полярные растворители смещают равновесие в сторону образования разделенных ионных пар и свободных ионов, что приводит к увеличению общей скорости полимеризации. При этом должна возрастать и степень полимеризации, однако такой эффект наблюдается не всегда, поскольку большинство полярных растворителей являются активными передатчиками или обрывателями кинетической цепи в катионной полимеризации. Поэтому катионная полимеризация обычно проводится в неполярных растворителях типа пентана или в малополярных, таких как CICH2-CH2CI, СН3Сl. Из растворителей повышенной полярности обычно используют нитросоединения, например нитробензол. В наибольшей степени скорость катионной полимеризации изменяется в том случае, когда замена растворителя на более полярный приводит к кардинальному изменению природы активных центров - от ковалентных (I) до ионных (III, IV). Такой эффект наблюдается в описанной выше полимеризации стирола, инициируемой HClO4, при -20°С. Скорость полимеризации увеличивается в 1000 раз при переходе от малополярного растворителя (CCl4, ε = 2,24) к умеренно полярному (1,2-дихлорэтан, ε = 9,72). Столь значительные эффекты скорее являются исключением. Дело в том, что сольватация ионов приводит к уменьшению их реакционной способности как активных центров. Этот эффект в значительной степени нейтрализует эффект, связанный с увеличением степени диссоциации ионной пары, и в результате скорость полимеризации в полярных растворителях возрастает примерно на порядок. Растворитель может также оказывать заметное влияние на порядок скорости полимеризации по мономеру. Если его сольватирующая способность по отношению к карбкатиону больше по сравнению с мономером, то порядок скорости по концентрации последнего равен трем, в противоположном случае или при соизмеримой сольватирующей способности - двум. Первый случай имеет место при полимеризации стирола, инициируемой SnCl4 в CCl4, второй - в бензоле. Выражение для суммарной энергии активации скорости и степени в катионной полимеризации может быть получено аналогично тому, как это сделано ранее при рассмотрении радикальной полимеризации. Исходя из уравнения (5.72), легко показать, что:
где Еин, Ер, Ео - энергии активации реакций инициирования, роста и обрыва цепи. Для катионной полимеризации знак Ev может изменяться в зависимости от условий полимеризации. При катионной полимеризации стирола, инициируемой TiCl4·H2O в CICH2-CH2CI, Ev = -35,5 кДж/моль, а при полимеризации того же мономера в том же растворителе, инициируемой три-хлоруксусной кислотой, Ev = +33,5 кДж/моль. В целом, значения суммарной энергии активации скорости катионной полимеризации находятся в широком интервале от -30 до +40 кДж/моль. В зависимости от знака Еv понижение температуры будет увеличивать (что бывает чаще) или уменьшать скорость катионной полимеризации. В отличие от предыдущего энергия активации степени полимеризации Ер всегда меньше нуля. Это связано с тем,что
где ЕM - энергия активации реакции передачи цепи на мономер, наиболее значимой из реакций, приводящих к ограничению материальной цепи, и ЕM > Ер.
|