Определение температурного режима химических аппаратов с гомогенной реакциейНаиболее распространенными в химической промышленности являются химические реакторы непрерывного действия с интенсивным перемешиванием реакционной массы и теплоотводом (рис. 3.15).
Отвод теплоты при проведении экзотермических реакций обычно применяется для того, чтобы избежать перегрева реакционной массы и не допустить, таким образом, нежелательных побочных реакций, фазовых переходов, термического разложения продуктов и т.д. Рассмотрим необратимую экзотермическую реакцию первого порядка по концентрации основного компонента С:
Количество теплоты в единицу времени, поступающей в реактор, складывается из теплоты входящего потока исходных реагентов Q1 = M1с1T1 и теплоты, выделяющейся в результате химической реакции Q х.р= hr V, где V – объем, занимаемый реагирующей массой. Из реактора теплота отводится с уходящим потоком продуктов реакции Q 2 = M2с2T и за счет теплопередачи через стенку аппарата Qт.о = к F(T - Таким образом, Q1 + Qx.p = Q2 + Qт.о. (3.59)
откуда
Концентрация С определяется из уравнения материального баланса реактора целевому компоненту: M1C1 - rV = M2C или
где М1 – расход (м3/с) исходных реагентов; М2 – расход продуктов реакции; С1 – концентрация исходных реагентов; С – концентрация целевого компонента (продукта); с1 и с2 – удельные (объемные) теплоемкости исходных реагентов и продуктов реакции соответственно; h – удельная теплота экзотермической реакции, Дж/кг. Уравнение (3.62) может быть решено относительно температуры процесса Т, которая установится для реакционной массы при всех заданных величинах.
Левая и правая линии дают только по одному устойчивому температурному режиму. Точки пересечения в верхней правой части кривых соответствуют установившемуся высокотемпературному процессу с высокой скоростью химической реакции и, соответственно, высокой степенью превращения. Высокие скорости теплоотвода (левая прямая) соответствуют низкотемпературному реагированию с малой скоростью химического превращения. Пунктирное продолжение кривой тепловыделения соответствует обратимой реакции. После нахождения величины Т определяется концентрация С. Аналогичный анализ химических реакций произвольного порядка приводит к более сложной алгебраической процедуре отыскания температуры устойчивого процесса. Для адиабатического реактора (к = 0) в уравнении теплового баланса исчезает слагаемое, соответствующее охлаждению зоны реакции, а порядок расчета остается прежним.
3.2.2. Теплообмен в системах с дисперсной твердой фазой
В технологических аппаратах теплообмен между дисперсной твердой фазой и жидкостью или газом может происходить в различных условиях. Ряд процессов происходит в неподвижном слое дисперсного материала фильтруемым через слой потоком. Есть аппараты с движущимся слоем дисперсного материала, который может обеспечить непрерывный процесс теплообмена как между самим потоком дисперсного материала и стенкой аппарата, так и между частицами дисперсного материала и потоком жидкости или газа, фильтрующимися через движущийся слой. Ряд технологических процессов проводится в установках, где взаимодействие дисперсного материала с газом происходит в условиях взвеси, то есть в потоке сплошной фазы, несущей с собой мелкодисперсный материал твердой фазы. В химической технологии, металлургии, энергетике и других отраслях промышленности получает широкое применение специфический метод осуществления контакта газовой (или жидкой) фазы с дисперсным материалом – метод псевдоожиженного, «кипящего» слоя. Сущность образования псевдоожиженного слоя состоит в том, что при некоторой скорости вертикального потока сплошной фазы Uкр сила гидравлического сопротивления, действующая на частицу в слое дисперсного материала, оказывается равной весу частицы (за вычетом подъемной силы Архимеда). При этом каждая частица оказывается в состоянии неустойчивого динамического равновесия. Дальнейшее увеличение скорости псевдоожижающего агента приводит к расширению слоя с сохранением динамического равновесия для каждой частицы, что обеспечивает равенство перепада статического давления на псевдоожиженном слое весу взвешенного дисперсного материала, приходящегося на единицу поперечного сечения слоя. При движении некоторой скорости Uун (скорость уноса) частицы материала начинают выноситься из слоя потоком сплошной среды. Таким образом, устойчивое состояние псевдоожиженного слоя возможно в диапазоне скорости взвешивающей среды Uкр£ U£ Uун. В последние годы в технологической практике находит применение специфический метод межфазного взаимодействия сплошной и дисперсной фаз в аппаратах фонтанирующего слоя. Явление фонтанирования дисперсного материала создается за счет подачи газа не равномерно по всему поперечному сечению слоя, как это делается в обычном псевдоожиженном слое, а локализованно. Аппарат фонтанирующего слоя представляет собой конус, обращенный усеченной вершиной вниз. По трубопроводу малого диаметра подается взвешивающая сплошная фаза со скоростью U, достаточной для того, чтобы в центре слоя дисперсного материала появился канал (фонтан) восходящего газа и частиц. На выходе из слоя скорость газа падает, а частицы материала отбрасываются к периферии аппарата. Фонтанирующий слой имеет ряд преимуществ по сравнению с псевдоожиженным слоем: отсутствие газораспределительного устройства (решетки), возможность взвешивать крупные частицы без значительного увеличения расхода газа, осуществлять фонтанирование дисперсных материалов широкого гранулометрического состава без уноса мелких фракций, обрабатывать слипающиеся и спекающиеся материалы.
|


 Перемешивание используется для создания однородных концентрационных и температур-ных условий по всему объему аппарата и интенсификации теплообмена реакционной массы с теплообменной поверхностью.
Перемешивание используется для создания однородных концентрационных и температур-ных условий по всему объему аппарата и интенсификации теплообмена реакционной массы с теплообменной поверхностью. (3.58)
(3.58) ), где к – коэффициент теплопередачи, F – площадь теплоотводящей поверхности,
), где к – коэффициент теплопередачи, F – площадь теплоотводящей поверхности, 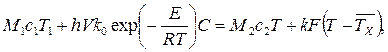 (3.60)
(3.60)

 (3.61)
(3.61) , (3.62)
, (3.62) Рассмотрим графический способ определения температуры реакции по этому уравнению (рис. 3.16). Графическое изображение правой части уравнения представляет собой прямые линии с различными углами наклона в зависимости от значений входящих в нее величин (М2,с2, k, F). График левой части представляет собой S-образную кривую зависимости тепловыделения от температуры. Решениями уравнения служат значения абсцисс точек пересечения графиков левой и правой частей уравнения.
Рассмотрим графический способ определения температуры реакции по этому уравнению (рис. 3.16). Графическое изображение правой части уравнения представляет собой прямые линии с различными углами наклона в зависимости от значений входящих в нее величин (М2,с2, k, F). График левой части представляет собой S-образную кривую зависимости тепловыделения от температуры. Решениями уравнения служат значения абсцисс точек пересечения графиков левой и правой частей уравнения. В случае, когда прямая линия теплоотвода пересекает кривую тепловыделения в трех точках, средняя точка b соответствует неустойчивому тепловому режиму, т.к. случайное увеличение температуры усилит тепловыделение значительнее, чем увеличится теплоотвод, что приведет к самопроизвольному возрастанию температуры до точки С. Если в точке b произойдет самопроизвольное падение температуры, то теплоотвод слева от b превысит выделение теплоты, что приведет к дальнейшему уменьшению температуры до точки а. В точках, соответствующих устойчивым температурным режимам (а, с), случайное увеличение температуры, наоборот, приведет к большему теплоотводу по сравнению с тепловыделением, что уменьшит температуру реакционной массы до стационарного значения.
В случае, когда прямая линия теплоотвода пересекает кривую тепловыделения в трех точках, средняя точка b соответствует неустойчивому тепловому режиму, т.к. случайное увеличение температуры усилит тепловыделение значительнее, чем увеличится теплоотвод, что приведет к самопроизвольному возрастанию температуры до точки С. Если в точке b произойдет самопроизвольное падение температуры, то теплоотвод слева от b превысит выделение теплоты, что приведет к дальнейшему уменьшению температуры до точки а. В точках, соответствующих устойчивым температурным режимам (а, с), случайное увеличение температуры, наоборот, приведет к большему теплоотводу по сравнению с тепловыделением, что уменьшит температуру реакционной массы до стационарного значения. Для эндотермических реакций с подводом теплоты тангенс угла наклона линии теплоподвода изменяет знак. Точка пересечения кривой теплопоглощения и линии подвода теплоты будет только одна, т.е. при подводе теплоты в зону эндотермической реакции любые температурные режимы оказываются устойчивыми (рис. 3.17).
Для эндотермических реакций с подводом теплоты тангенс угла наклона линии теплоподвода изменяет знак. Точка пересечения кривой теплопоглощения и линии подвода теплоты будет только одна, т.е. при подводе теплоты в зону эндотермической реакции любые температурные режимы оказываются устойчивыми (рис. 3.17). В общем случае для непрерывного реактора полного смешения возможны различные варианты температурных режимов, о чем можно судить с достаточной полнотой лишь по результатам конкретного анализа уравнений химической кинетики, теплового и материального балансов.
В общем случае для непрерывного реактора полного смешения возможны различные варианты температурных режимов, о чем можно судить с достаточной полнотой лишь по результатам конкретного анализа уравнений химической кинетики, теплового и материального балансов.


