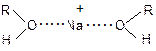Подлинности веществФизические константы. Нахождение температур плавления и кипения, плотности, показателя преломления и сопоставление их с литературными данными дают полезную для идентификации информацию. Растворимость. Использование растворимости органических веществ в определенных растворителях и реагентах в целях классификации более обосновано. Эта характеристика связана с химическими свойствами данного органического вещества. Органические вещества обычно нерастворимы в воде, хотя некоторые из них малорастворимы в воде и легкорастворимы в спиртах. В то же время большее число органических веществ растворяется в неполярных растворителях. Растворение жидкостей в жидкости также может служить их характеристикой. Обычно неполярные жидкости растворяются в спиртах или их смесях с водой лучше, чем твердые вещества. Для рационального выбора растворителя при проведении анализа растворители удобно сгруппировать по определенным свойствам. Из физических свойств, прежде всего, важна диэлектрическая проницаемость растворителя e, поскольку с ней связана диссоциирующая способность среды. По значению e растворители делятся на три группы: – растворители с высокими значениями (e > 40); в них в разбавленных растворах соединение полностью диссоциировано. – растворители со средними значениями (15 < e > 40); в них растворенные соединения значительно ассоциированы (неполная диссоциация). – растворители с низкими значениями (e <15); в них растворенные соединения находятся в виде недиссоциированных молекул или ассоциатов. Растворение веществ в органических растворителях часто является не только физическим процессом, так как при этом возможны взаимодействия и даже химические реакции между молекулами растворенного вещества и растворителя. В результате этого молекулы растворителя в растворах могут приобретать свойства, отличные от их свойств в чистых жидкостях. Например, сильнополярное вещество при растворении поляризует молекулы растворителя. Растворитель может затруднять реакции между растворенными веществами, поэтому его нельзя во всех случаях считать просто инертной средой. В связи с этим все растворители классифицируют на следующие группы: 1. Протонные растворители – это соединения, молекулы которых способны отдавать или присоединять протоны. Наибольшее значение имеют вода, спирты, амины и карбоновые кислоты. Эти растворители растворяют многие ионные и ковалентные соединения, при этом молекулы и ионы растворенных веществ в их растворе существенно сольватированы. Они обладают как нуклеофильными, так и электрофильными свойствами. Диэлектрическая проницаемость этих растворителей колеблется в широких пределах. В этих растворителях анионы сильно сольватированы, и атомы водорода этих растворителей способны к образованию водородных связей:
R–Od––Hd+...... Br–..... Hd+ –Od––R
Поскольку эти растворители имеют неподеленную пару электронов и обладают электронодонорными свойствами, они могут сольватировать катионы:
2. Неполярные или малополярные апротонные растворители – это соединения нейтрального характера, молекулы которых не способны ни отдавать, ни присоединять протоны, их молекулы не ионизированы. Они в меньшей степени растворяют ионные соединения, а вещества с ковалентным типом связи – гораздо легче. Растворители этой группы (углеводороды и их галогенпроизводные, диэтиловый эфир, бензол, диоксан, пиридин) имеют низкую диэлектрическую проницаемость. 3. Диполярные апротонные растворители. К этой группе относятся ацетон, диметилсульфоксид, нитробензол и др. Данные растворители имеют относительно высокую диэлектрическую проницаемость и отсутствие атомов водорода для образования водородной связи. Основные физические константы некоторых широко используемых органических растворителей приведены в табл. 1. Основываясь на растворимости органических веществ в воде и эфире, их можно разделить на следующие группы: Группа I. Растворимы в воде, нерастворимы в эфире. Вещества, на свойства которых преобладающее влияние оказывают полярные группировки: соли, сахара, аминоспирты, оксикарбоновые кислоты, ди- и поликарбоновые кислоты, амиды, алифатические аминокислоты, сульфокислоты. Группа II. Растворимы в эфире, нерастворимы в воде. Вещества, на свойства которых преобладающее влияние оказывают неполярные группы: углеводороды и их галогенпроизводные, простые и сложные эфиры, спирты с более чем пятью атомами углерода, высшие альдегиды и кетоны, средние и высшие карбоновые кислоты, ароматические карбоновые кислоты, фенолы, тиофенолы, высшие амины. Группа III. Растворимы и в воде, и в эфире. Это вещества, на свойства которых оказывают влияние и полярные и неполярные группы: низшие алифатические спирты, низшие алифатические альдегиды и кетоны, амиды кислот, низшие и средние карбоновые кислоты, многоатомные фенолы, алифатические амины, аминофенолы. Группа IV. Нерастворимы ни в воде, ни в эфире. К этой группе относятся высокомолекулярные вещества, некоторые аминокислоты (цистин, тирозин), высшие амины. Таблица 1. Физические константы некоторых широко используемых растворителей
Таким образом, система классификации органических веществ по их растворимости в различных растворителях включает деление на две большие группы по отношению их растворимости в воде. Затем каждая из этих групп подразделяется на основании их отношения к другим растворителям. В свою очередь, растворимые в воде соединения делятся на две группы: соединения, растворимые в эфире, и соединения, нерастворимые в нем. Далее на основании растворимости органических соединений в растворах кислот и оснований они подразделяются на кислые, основные и нейтральные соединения. Вещества, имеющие кислый характер, растворяются в растворах щелочей или в растворе бикарбоната натрия с образованием солей. Органические кислоты, главным образом низкомолекулярные, константа диссоциации которых больше, чем у угольной кислоты (4,3·10–7) (например, для уксусной кислоты 1,7·10–5), растворяются в растворах бикарбонатов с выделением углекислого газа:
НА + NaHCO3 = H2O + CO 2 + NaA.
Более слабые кислоты, константа диссоциации которых больше, чем вторая константа диссоциации угольной кислоты (5,6·10–11), растворяются без образования углекислого газа. Растворимы и в щелочах, и в растворе бикарбоната натрия карбоновые, сульфоновые кислоты, нитрофенолы. В растворах щелочей растворимы фенолы, тиофенолы, меркаптаны, первичные алифатические нитросоединения. При действии щелочей органические основания выделяются в виде солей в кристаллическом состоянии, либо в виде масел. Жирные кислоты с числом углеродных атомов более 12 при добавлении щелочей уже не дают прозрачных растворов: вместо этого образуются опалесцирующие мыльные растворы. В разбавленной соляной кислоте растворимы алифатические и ароматические амины вследствие образования гидрохлоридов. Следует отметить, что растворимость ариламинов сильно падает с увеличением числа арильных групп: для дифениламина она очень мала, а трифениламин практически нерастворим. Некоторые вещества растворимы как в кислотах, так и в щелочах. К числу подобных амфотерных веществ относятся аминокислоты, аминофенолы, аминосульфоновые кислоты. Для исследования нейтральных веществ, нерастворимых в воде, можно использовать концентрированную серную кислоту. Растворение в ней часто сопровождается химическими реакциями, признаком которых может являться разогревание, выделение газов и т.д. Проба с серной кислотой не дает возможности отнести вещество к одной из перечисленных выше групп, однако она позволяет сделать полезные выводы: ненасыщенные соединения превращаются в водорастворимые эфиры серной кислоты, кислородсодержащие соединения обычно переходят в раствор с образованием оксониевых солей, спирты этерифицируются или гидратируются, олефины могут полимеризоваться, некоторые углеводороды сульфируются, иод- и бромсодержащие соединения разлагаются с выделением иода и брома. Насыщенные алифатические и ароматические углеводороды, а также их галогенпроизводные нерастворимы в концентрированной серной кислоте. В НД включен метод фазовой растворимости, который дает возможность осуществлять количественную оценку степени чистоты веществ путем точных измерений значений растворимости. Этот метод основан на правиле фаз Гиббса, которое устанавливает зависимость между числом фаз и числом компонентов в условиях равновесия. Суть установления фазовой растворимости заключается в последовательном прибавлении увеличивающейся массы препарата к постоянному объему растворителя. Для достижения состояния равновесия смесь подвергают длительному встряхиванию при постоянной температуре, а затем с помощью диаграмм определяют содержание растворенного вещества, т.е. устанавливают, является ли испытуемый препарат индивидуальным веществом или смесью. Метод фазовой растворимости отличается объективностью, не требует для выполнения дорогостоящего оборудования, знания природы и структуры примесей. Это позволяет использовать его для качественного и количественного анализов, а также для изучения стабильности и получения очищенных образцов препаратов. Важное достоинство метода – возможность отличать оптические изомеры и полиморфные формы веществ. Метод применим ко всем видам соединений, которые образуют истинные растворы. Температура. Константой, характеризующей гомогенность твердых веществ, является температура плавления. Ее используют для установления подлинности и чистоты большинства твердых веществ. Известно, что это значение температуры, при которой твердое тело находится в равновесии с жидкой фазой при насыщенной фазе пара. Температура плавления является постоянной величиной для индивидуального вещества. Присутствие даже небольшого содержания примесей изменяет температуру плавления вещества, что позволяет судить о степени его чистоты. Подтвердить индивидуальность исследуемого соединения можно пробой смешанного плавления, так как смесь двух веществ, имеющих одинаковую температуру плавления, плавится при той же температуре. Для установления температуры плавления НД рекомендует капиллярный метод, позволяющий подтвердить подлинность и ориентировочно степень чистоты препарата. Поскольку в препаратах допускается некоторое содержание примесей, то температура плавления может быть выражена не всегда четко. Поэтому под температурой плавления подразумевают интервал температур, при котором происходит процесс плавления испытуемого препарата от появления первых капель жидкости до полного перехода вещества в жидкое состояние. Некоторые органические соединения при нагревании разлагаются. Процесс этот происходит при температуре разложения и зависит от ряда факторов, в том числе от скорости нагрева. В зависимости от физических свойств применяют различные методы установления температуры плавления. Одни из них рекомендуются для твердых веществ, легко превращаемых в порошок, а другие – для веществ, не растирающихся в порошок (жиры, воск, парафин, вазелин и др.). Следует учитывать, что на точность установления температурного интервала, при котором происходит плавление испытуемого вещества, могут влиять условия подготовки образца, скорость подъема и точность измерения температуры, опытность аналитика. Под температурой затвердевания понимают наиболее высокую остающуюся в течение короткого времени постоянную температуру, при которой происходит переход вещества из жидкого состояния в твердое. Температура кипения, или температурные пределы перегонки – это интервал между начальной и конечной температурой кипения при нормальном давлении 760 мм рт. ст. Температуру, при которой в приемник перегнались первые пять капель жидкости, называют начальной температурой кипения, а температуру, при которой перешло в приемник 95% жидкости, – конечной температурой кипения. Указанные пределы температур можно установить макрометодом и микрометодом. Следует учитывать, что температура кипения зависит от атмосферного давления. Температуру кипения устанавливают только у сравнительно небольшого числа жидких лекарственных препаратов: циклопропана, хлорэтила, эфира, хлороформа, трихлорэтилена, этанола. При установлении плотности берут массу вещества определенного объема. Плотность устанавливают с помощью пикнометра или ареометра строго соблюдая температурный режим, так как плотность зависит от температуры. Обычно это достигают термостатированием пикнометра при температуре 20ºС. Определенные интервалы значений плотности подтверждают подлинность этилового спирта, глицерина, масла вазелинового, вазелина, парафина твердого, галогенпроизводных углеводородов, раствора формальдегида и др. Дистилляцию осуществляют кипячением определенных количеств спиртовых смесей в колбах, герметически соединенных с приемником. Последний представляет собой мерную колбу вместимостью 50 мл. Собирают 45 мл отгона, доводят его температуру до 20ºС и добавляют водой до метки. Плотность отгона устанавливают пикнометром. При термическом разложении органических веществ образуются вещества с меньшей молекулярной массой и характерными химическими свойствами. Они могут быть неорганическими (сероводород, углекислый газ и др.) или органическими веществами (муравьиный альдегид, метанол, уксусная кислота и т.д.). Те же вещества могут получаться при нагревании в присутствии окислителей или восстановителей. Например, серосодержащие вещества могут выделять соответственно сероводород или диоксид серы. Некоторые вещества разлагаются с образованием летучих альдегидов или кислот, которые можно определить в газовой фазе посредством простых реакций. Под влиянием тепла некоторые вещества сублимируются или после плавления испаряются. Вещества с высоким содержанием углерода и низким содержаниемкислорода можно определить по сильно коптящему и светящемуся пламени. Вещества с низким содержанием углерода и относительно богатые кислородом (главным образом, алифатические соединения) дают слабо светящееся или бесцветное пламя. Вещества, вспучивающиеся при нагревании, а затем после плавления начинающие кипеть, обычно содержат кристаллизационнную воду. Продукты горения иногда имеют характерный запах: сахара дают запах карамели, белки – запах жженых волос. Продукты горения всех углеводородов и аминосоединений не имеют запаха. Вязкость – это физическая константа, подтверждающая подлинность жидких веществ. Различают динамическую, кинематическую, относительную, удельную, приведенную и характеристическую вязкость. Каждая из них имеет свои единицы измерения. Для оценки качества жидких препаратов, имеющих вязкую консистенцию, например глицерина, вазелина, масел, обычно определяют относительную вязкость. Она представляет собой отношение вязкости исследуемой жидкости к вязкости воды принятой за единицу. Для измерения кинематической вязкости используют различные модификации вискозиметров типа Оствальда и Уббелоде. Зная плотность исследуемой жидкости, можно вычислить динамическую вязкость. Последнюю можно также установить с помощью ротационных вискозиметров различных модификаций или микрореометров. На измерении скорости падения шарика в жидкости основано устройство вискозиметров типа Гепплера. Они позволяют установить показатель динамической вязкости жидкости. Все приборы должны термостатироваться, так как вязкость в значительной степени зависит от температуры испытуемой жидкости. Запах. Органические соединения в отличие от неорганических часто имеют характерный запах, указывающий на класс соединения, к которому может принадлежать исследуемое вещество. Характерным запахом обладают: углеводороды терпенового ряда, пинаколин («терпеновый запах»); низшие спирты; низшие жирные кислоты (муравьиная и уксусная кислоты имеют очень резкий запах, пропионовая и более высшие кислоты – неприятный запах пота); низшие кетоны; альдегиды; галогенпроизводные (дурманяще-сладковатый запах); ароматические нитросоединения (запах горького миндаля); фенолы (запах «карболки»); эфиры фенолов (анисовый или укропный запах); сложные эфиры (фруктовые запахи); изонитрилы (неприятно сладкий тошнотворный запах); меркаптаны, тиоэфиры (неприятный запах, напоминающий сероводород).
|