Способы выражения состава растворов.
4. Большинство веществ, находящихся в кристаллическом состоянии, растворяются в жидкостях с поглощением теплоты. Однако при растворении в воде гидроксида натрия, карбоната калия, безводного сульфата меди и многих других веществ происходит заметное повышение температуры. Выделяется теплота также при растворении в воде некоторых жидкостей и всех газов. Количество теплоты, поглощающейся (или выделяющейся) при растворении одного моля вещества, называется теплотой растворения этого вещества. Теплота растворения имеет отрицательное значение, если при растворении теплота поглощается, и положительное — при выделении теплоты. Например, теплота растворения нитрата аммония равна —26,4 кДж/моль, гидроксида калия +55,6 кДж/моль и т. д. Процесс растворения сопровождается значительным возрастанием энтропии системы, так как в результате равномерного распределения частиц одного вещества в другом резко увеличивается число микросостояний системы. Поэтому, несмотря па эндотермичность растворения большинства кристаллов, изменение энергии Гиббса системы при растворении отрицательно и процесс протекает самопроизвольно. При растворении кристаллов происходит их разрушение, что требует затраты энергии. Поэтому растворение должно было бы сопровождаться поглощением теплоты. Если же наблюдается обратный эффект, то это показывает, что одновременно с растворением происходит какое-то взаимодействие между растворителем и растворенным веществом, при котором выделяется в виде теплоты больше энергии, чем ее расходуется иа разрушение кристаллической решетки. Действительно, в настоящее время установлено, что при растворении многих веществ их молекулы (или ионы) с молекулами растворителя, образуя соединения, называемые с о л ь в а т а м и (от латинского solvere — растворять); этот процесс называется сольватацией. В частном случае, когда растворителем является вода, эти соединения называются гидратами, а самый процесс их образования — гидратацией Гидраты, как правило, нестойкие соединения, во многих случаях разлагающиеся уже при выпаривании растворов. Но иногда гидраты настолько прочны, что при выделении растворенного вещества из раствора вода входит в состав его кристаллов. Вещества, в кристаллы которых входят молекулы воды, называются кристаллогидратами, а содержащаяся в них вода — к р и -. с т а л л и з а ц и о и н о й. Состав кристаллогидратов принято изображать формулами, показывающими, какое количество кристаллизационной воды содержит кристаллогидрат. Например, кристаллогидрат сульфата меди (медный купорос). Прочность связи между веществом и кристаллизационной водой в кристаллогидратах различна. Многие из них теряют кристаллизационную воду уже при комнатной температуре. Так, прозрачные кристаллы соды (НагС03- 10Н2О) легко «выветриваются», — теряя кристаллизационную воду, становятся тусклыми и постепенно рассыпаются в порошок. Для обезвоживания других кристаллогидратов требуется довольно сильное нагревание. 5. Растворимостью называется способность вещества растворяться в том или ином растворителе. Мерой растворимости вещества при данных условиях служит содержание его в насыщенном растворе. Поэтому численно растворимость может быть выражена теми же способами, что и состав, например, процентным отношением массы растворенного вещества к массе насыщенного раствора или количеством растворенного вещества, содержащимся в 1 л насыщенного раствора. Часто растворимость выражают также числом единиц массы безводного вещества, насыщающего при данных условиях 100 единиц массы растворителя; иногда выраженную этим способом растворимость называют коэффициентом растворимости. Растворимость различных веществ в воде изменяется в широких пределах. Если в 100 г воды растворяется более 10 г вещества, то такое вещество принято называть хорошо растворимым; если растворяется менее 1 г вещества — малорастворимым и, наконец, практически нерастворимым, если в раствор переходит менее 0,01 г вещества. Растсорение большинства твердых тел сопровождается поглощением теплоты. Это объясняется затратой значительного количества энергии на разрушение кристаллической решетки твердого тела, что обычно не полностью компенсируется энергией, выделяющейся при образовании гидратов (сольватов). Прилагая принцип Ле Шателье к равновесию между веществом в кристаллическом состоянии п его насыщенным раствором приходим к выводу, что в тех случаях, когда вещество растворяется с поглощением энергии, повышение температуры должно приводить к увеличению его растворимости В большинстве подобных случаев с повышением температуры взаимная растворимость жидкостей увеличивается до тех пор, пока не будет достигнута температура, при которой обе жидкости смешиваются в любых пропорциях. При растворении твердых тел в воде объем системы обычно изменяется незначительно. Поэтому растворимость веществ, находящихся в твердом состоянии, практически не зависит от давления. Жидкости также могут растворяться в жидкостях. Некоторые из них неограниченно растворимы одна в другой, т. е. смешиваются друг с другом в любых пропорциях, как, например, спирт и вода, другие — взаимно растворяются лишь до известного предела. Температура, прн которой ограниченная взаимная растворимость жидкостей переходит в неограниченную, называется критической температурой растворения закон распределения, согласно которому вещество, способное растворяться в двух несме-ишвающихся растворителях, распределяется между ними так, что отношение его концентраций в этих растворителях при постоянной температуре остается постоянным, независимо от общего количества растворенного вещества: С1/С2 = К Здесь С1 и С2—концентрации растворенного вещества в первом и втором растворителях; /(— так называемый коэффициент распределения. Растворение газов в воде представляет собой экзотермический процесс. Поэтому растворимость газов с повышением температуры уменьшается. Если оставить в теплом помещении стакан с холодной водой, то внутренние стенки его покрываются пузырьками газа — это воздух, который был растворен в воде, выделяется из нее вследствие нагревания. Кипячением можно удалить из воды весь растворенный в ней воздух. Однако растворение газов в органических жидкостях нередко сопровождается поглощением теплоты; в подобных случаях с ростом температуры растворимость газа увеличивается. Закон Генри:Масса газа, растворяющегося при постоянной температуре в данном объеме жидкости, прямо пропорциональна парциальному давлению газа. Закон Генри может быть выражен уравнением С = kp где С — массовая концентрация газа в насыщенном растворе; р — парциальное давление; k — коэффициент пропорциональности, называемый константой Генри (или коэффициентом Генри). Отметим важное следствие закона Генри: объем газа, растворяющегося при постоянной температуре в данном объеме жидкости, не зависит от его парциального давления. Если над жидкостью находится смесь нескольких газов, то растворимость каждого из них определяется его парциальным давлением. Это необходимо учитывать при расчете растворимости газов, находящихся в смеси с другими газами. Газы подчиняются закону Генри пи не очень высоких давлениях и притом лишь в случае, когда они не вступают в химическое взаимодействие с растворителем. При высоких давлениях, когда поведение всех газов заметно отличается от идеального, отклоненне от закона Генри наблюдается и в случае газов, химически не взаимодействующих с растворителем. 6. Растворимость большинства веществ уменьшается с понижением температуры, поэтому при охлаждении горячих насыщенных растворов избыток растворенного вещества обычно выделяется. Однако, если производить охлаждение осторожно и медленно, защитив при этом раствор от возможности попадания в него частиц растворенного вещества извне, то выделения его из раствора может и не произойти. В этом случае получится раствор, содержащий значительно больше растворенного вещества, чем его требуется для насыщения при данной температуре. Это явление было открыто и подробно изучено русским академиком Т. Е. Ловицем (1794 г.), который назвал такие растворы пересыщенными. В спокойном состоянии они могут годами оставаться без изменения. Но стоит только бросить в раствор кристаллик того вещества, которое в нем растворено, как тотчас же вокруг него начинают расти другие кристаллы и через короткое время весь избыток растворенного вещества выкристаллизовывается. Иногда кристаллизация начинается от простого сотрясенияраствора, а также от трения стеклянной палочкой о стенки сосуда, в котором находится раствор. При кристаллизации выделяетсязначительное количество теплоты, так что сосуд с раствором за-метно нагревается. Очень легко образуют пересыщенные рас-творы Na2SO4-10H2O (глауберова соль), Na2B407- 10Н2О (бура),Na2S203-5H20 (тиосульфат натрия). Из сказанного следует, что пересыщенные растворы являются неустойчивыми системами, способными к существованию только при отсутствии в системе твердых частиц растворенного вещества. Возможность длительного существования таких растворов объясняется трудностью первоначального возникновения мельчайших «зародышевых» кристалликов, так называемых центров кристаллизации, от которых кристаллизация распространяется на всю массу раствора. 7. раствор представляет собой го-могенную систему. Частицы растворенного вещества и растворителя находятся в беспорядочном тепловом движении и равномерно распределяются по всему объему раствора. Если поместить в цилиндр концентрированный раствор какого-либо вещества, например, сахара, а поверх него осторожно налить слой более разбавленного раствора сахара, то вначале сахар и вода будут распределены в объеме раствора неравномерно
При измерениях осмотического давления различных растворов было установлено, что величина осмотического давления зависит от концентрации раствора и от его температуры, но не зависит ни от природы растворенного вещества, ни от природы растворителя. В 1886 г. Вант-Гофф показал, что для растворов неэлектролитов невысоких концентраций зависимость осмотического давления от концентрации температуры раствора выражается уравнением (закон Вант-Гоффа): P = CRT Здесь Р — осмотическое давление раствора, кПа; С — его молярная концентрация (молярность), моль/л; R — универсальная газовая постоянная, 8,314 Дж/(моль-К); Т—абсолютная температура раствора. 8. При данной температуре давление насыщенного пара над каждой жидкостью — величина постоянная. Опыт показывает, что при растворении в жидкости какого-либо вещества давление насыщенного пара этой жидкости понижается. Таким образом, давление насыщенного пара растворителя над раствором всегда ниже, чем, над чистым растворителем при той же температуре. Разность между этими величинами принято называть понижением давления пара над раствором (или понижением давления пара раствора). Отношение величины этого понижения к давлению насыщенного пара над чистым раствори, телем называется относительным понижением давления пара над раствором. Обозначим давление насыщенного пара растворителя над чистым растворителем через р0, а над раствором через р. Тогда относительное понижение давления пара над раствором будет представлять собою дробь:(Ро — Р)/Ро В 1887 г. французский физик Рауль, изучая растворы различных нелетучих жидкостей и веществ в твердом состоянии, установил закон, связывающий понижение давления пара над разбавленными растворами неэлектролитов с концентрацией: Относительное понижение давления насыщенного пара растворителя над раствором равно молярной доле растворенного вещества. Математическим выражением закона Рауля является уравнение: (.Ро — Р)/Ро = Ni Здесь N2 — молярная доля растворенного вещества. Явление понижения давления насыщенного пара над раствором вытекает из принципа Ле Шателье. 9. Индивидуальные вещества характеризуются строго определëнными температурами переходов из одного агрегатного состояния в другое (температура кипения, температура плавления, температура сублимации и т. п.). Так вода, при нормальном атмосферном давлении (101,3 кПа) кристаллизуется при 0°С и кипит при 100°С. Иначе обстоит дело с растворами. Присутствие растворëнного вещества повышает температуру кипения и понижает температуру замерзания растворителя, и тем сильнее, чем концентрированнее раствор. В большинстве случаев из раствора кристаллизуется из раствора (при замерзании) или выкипает (при кипении) только растворитель, вследствие чего концентрация раствора в ходе его замерзания или кипения возрастает. Это в свою очередь приводит к ещë большему повышению температуры кипения и снижению температуры кристаллизации. Таким образом, раствор кристаллизуется и кипит не при определëнной температуре, а в некотором температурном интервале. Температуру начала кристаллизации и начала кипения данного раствора называют его температурой кристаллизации и температурой кипения. Разность между температурами кипения раствора (tк) и чистого растворителя (tок) называют повышением температуры кипения раствора (Δtк). Разность между температурами замерзания чистого растворителя (tОЗ) раствора (tЗ) называют понижением температуры замерзания раствора (ΔtЗ). Δtк = tк – tок; ΔtЗ = tОЗ – tЗ. Всякая жидкость начинает кипеть при той температуре, при которой давление еë насыщенного пара достигает величины внешнего давления. Например, вода под давлением 101,3 кПа кипит при 100°С потому, что при этой температуре давление водяного пара как раз равно 101,3 кПа. Если же растворить в воде какое-нибудь нелетучее вещество, то давление еë пара понизится. Чтобы довести давление пара полученного раствора до 101,3 кПа, нужно нагреть раствор выше 100°С. Отсюда следует, что температура кипения раствора всегда выше температуры кипения чистого растворителя. Аналогично объясняется и понижение температуры замерзания растворов. Повышение температуры кипения и понижение температуры замерзания растворов соответствуют принципу Ле Шателье. Рассмотрим процесс замерзание раствора. Пусть имеется равновесие между жидкостью и твëрдой фазой, например, равновесие вода - лëд при 0°С. Его можно выразить уравнением: Н2О(К) Если растворить в воде некоторое количество какого-либо вещества, то концентрация молекул воды в жидкости понизится и пойдëт процесс, увеличивающий еë, - плавление льда. Для установления нового равновесия необходимо понизить температуру. Согласно второму закону Рауля: для разбавленных растворов неэлектролитов повышение температуры кипения и понижение температуры замерзания пропорциональны концентрации раствора. ΔТК = Э·Сm(B); ΔТЗ = К·Сm(В). Здесь Сm(В) - моляльная концентрация; Э и К - эбулиоскопическая и криоскопическая постоянные, зависящие только от природы растворителя, но не зависящие от природы растворëнного вещества. Для воды криоскопическая постоянная К равна 1,86, эбулиоскопическая постоянная Э равна 0,52.На измерениях температур кипения и замерзания растворов основаны эбулиоскопический и криоскопический методы определения молекулярных масс веществ. 10. Буферные растворы – растворы, концентрация ионов водорода (рН) которых не изменяется от прибавления ограниченных количеств сильной кислоты или щелочи (см. водородный показатель). Б.р. состоят из смеси раствора слабой кислоты и ее соли сильного основания или, наоборот, — слабого основания и его соли сильной кислоты, например: СН3СOOН+СН3СOONa — ацетатный буфер, NH4OH+NHCl — аммиачный буфер. Иногда Б.р. может служить смесь растворов двух кислых или кислой и основной солей многоосновной слабой кислоты и сильного основания. Например, фосфатный Б.р. может быть составлен из следующих пар: 1) H3PO4+NaH2PO4; 2) NaH2PO4+Na2HPO4; 3) Na2HPO4+Na3PO4, а карбонатный — из 1) H2CO3+NaHCO3; 2) NaHCO3+Na2CO3. Действие Б.р. определяется наличием двух взаимосвязанных равновесных систем — диссоциацией и гидролизом. Для определения пределов действия Б.р. вводится понятие буферная емкость, измеряемая количеством сильной кислоты или основания (в г-экв), которое надо добавить к 1 л Б.р., чтобы сместить рН на единицу. Максимальная буферная емкость соответствует содержанию компонентов в эквивалентных количествах. В маломинерализованных природных водах буферность в основном создается карбонатами, т.е. свободной угольной кислотой и ее солями сильных оснований (Ca, Mg, Na). В морских водах в образовании буферности участвует и боратный буфер. Буферная емкость морской воды при 0оС в 11 раз выше, чем у раствора NaCl с концентрацией 35о/оо и в 9 раз выше, чем у дистиллированной воды. При 30оС превышение составляет соответственно 25 и 19 раз. Такое увеличение буферной емкости морской воды с температурой связано с усилением диссоциации и гидролиза компонентов, составляющих буферность. У дистиллированной воды буферность несколько выше, чем у раствора NaCl за счет лучшей растворимости СO2. Поскольку величина рН зависит не от концентраций компонентов, а от их соотношения, то при разбавлении Б.р. она остается постоянной. В то же время, несмотря на высокую буферную емкость природных вод, процессы фотосинтеза (см.) или дыхания сильно влияют на величину рН, так как при этом меняются соотношения между концентрациями СO2 и НСO3–. Б.р. играют важную роль в живых организмах. Можно добавить, что строго фиксированные величины рН в различных органах высших животных и человека, как правило, поддерживаются не одним, а целой системой Б.р., например, в крови — буферными растворами на основании карбонатов и фосфатов. Кислые или щелочные стоки, попадающие в водоем, могут быть нейтрализованы карбонатной буферной системой природных вод. Это же способствует поддержанию постоянства рН воды при введении реагентов в процессе обработки воды. При биологической очистке сточных вод (см.) оптимальные величины рН для нормального протекания процессов жизнедеятельности микроорганизмов поддерживаются наличием буферных систем (карбонатной, аммонийной и фосфатной систем). Кроме того, Б.р. широко используются при химическом анализе воды.
|





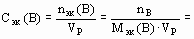
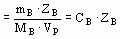


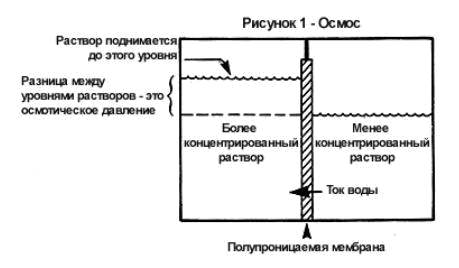 . Однако через некоторое время молекулы сахара и воды вновь равномерно распределятся по всему объему жидкости. Это происходит потому, что молекулы сахара, беспорядочно двигаясь, проникают как из концентрированного раствора в разбавленный, так и в обратном направлении; но при этом в течение любого промежутка времени из более концентрированного раствора в менее концентрированный переходит больше молекул сахара, чем из разбавленного раствора в концентрированный. Точно так же молекулы воды движутся в различных направлениях, но при этом из разбавленного раствора, более богатого водой, в концентрированный раствор переходит больше молекул воды, чем за то же время переносится в обратном направлении. Таким образом возникает направленное перемещение сахара из концентрированного раствора в разбавленный, а воды — из разбавленного раствора в концентрированный; каждое вещество переносится при этом туда, где его концентрация меньше. Такой самопроизвольный процесс перемещения вещества, приводящий к выравниванию его концентрации, называется диффузией.
. Однако через некоторое время молекулы сахара и воды вновь равномерно распределятся по всему объему жидкости. Это происходит потому, что молекулы сахара, беспорядочно двигаясь, проникают как из концентрированного раствора в разбавленный, так и в обратном направлении; но при этом в течение любого промежутка времени из более концентрированного раствора в менее концентрированный переходит больше молекул сахара, чем из разбавленного раствора в концентрированный. Точно так же молекулы воды движутся в различных направлениях, но при этом из разбавленного раствора, более богатого водой, в концентрированный раствор переходит больше молекул воды, чем за то же время переносится в обратном направлении. Таким образом возникает направленное перемещение сахара из концентрированного раствора в разбавленный, а воды — из разбавленного раствора в концентрированный; каждое вещество переносится при этом туда, где его концентрация меньше. Такой самопроизвольный процесс перемещения вещества, приводящий к выравниванию его концентрации, называется диффузией. Н+ + ОН–
Н+ + ОН–


