Католиз-увеличение скорости р-ции в присутствие в-в, принимающ. Участие только в промежут стадии протекания р-ии , но после выделяющ в таких же кол-вах и неизменном химич виде.1.Видатні представники, провідні школи течії і напрямки схоластичної герменевтики. 2. Проблема герменевтичного кола в герменевтиці М.Лютера та М.Флаціуса. 3. Базові техніки контекстуального тлумачення в герменевтиці Августина Аврелія.
Тепловой эффект реакции протекающ в изобарном() или изохорном () режимах,не зависят от числа промежут стадий, а определяются лишь нач. и конечн. Сост. Сис-мы. Тепловой эффект реакции= по модулю и противоположен по знаку дельта Н обратной реакции 1.6
Стандартная энтальпия сгорания 1следствие: тепловой эффект реакции= разности между суммами теплот образования продуктов и исходных веществс учетом их стехиометрических коэффициентов. Δ H реакции Различие между энтальпией сгор. И образования: эти величины являются энтальпиями разных химических реакции Пример: Энтальпия образования монооксида углерода определяется из реакции:
2C т + O2 г = 2CO г; ΔH° = -220 кДж/моль ΔH°CO = ΔH° / nCO = -220 кДж/2 моль = -110 кДж/моль
а энтальпия сгорания того же вещества - из реакции:
2CO г + O2 г = 2CO2 г; ΔH° = -220 кДж/моль ΔH°сг CO = ΔH° / nCO = -566 кДж/2 моль = -283 кДж/моль
Энтальпию реакции можно расчитать не только по энтальпиям образования продуктов реакции и реагентов, но и по энтальпии сгорания веществ, участвующих в реакции. В соответствии с законом Гесса энтальпия реакции равна разности между суммой энтальпий сгорания реагентов и суммой энтальпий сгорания продуктов реакции. 1.7 Изменение энтальпии не может служит полноценным критерием самопроизвольности протекания реакции, хотя известен принцип бертло томсона, согласно которому самопроизвольно могут идти только те реакции, которые идут с выделением тепла. Система стремится к минимуму энергии, поэтому её потеря- явление выгодное.-это стабилизирует систему. Существует целый ряд процессов, которые протекают самопроизв, но сопровожд либо нулевым тепловым эф, либо дельта Н<0. Движущей силой этих процессов явл рост беспорядка в системе, мерой которого является изменение энтропии(дельтаS>0)
Равномерное распределения газа во всем объемеявляется термодинамически наиб. Выгодным,тк. Реализуется наибольшим числом способов w= w- термодинамич. Вероятность, кот характериз. Число микросост, кот. Реализ данное макростостояние. Энтрапия идеального кристалла при нуле кельвина=0. В т. Плавления и кипения энтропия скачкообразно возрастает. Если в ходе ре-ции выдел. Газ, то д.S>0 Если и реагенты и прод. Ре-ции газы, но в ходе реакции уменьшается число моль участников, то дельта S<0 Если число моль газов в левой и правой ч. Одинаковы, то дSприближается к нулю=0, здесь знак можно определить по сложности мол-л. ДSлюбой реакции можно так же расчитать, пользуясь табличными данными по формуле
2закон термодинамики: в изолир. Системах самопроизвольно могут протекать только те р-ии, которые сопровождаются ростов S. В закрытых и открытых системах так же могут протекать р-иии, д S которых <0. 1.9. Закон Действующих масс-устанавливает соотнош. Между массами раег. В-в в химич. Реакциях при равновесии. Составлен Гульдбергом и Вааге Закон действующих масс - скорость химической реакции пропорциональна произведению концентраций реагирующих веществ. Скорость химич. Реакции характеризует изменение конц. Реаг.ве-в в единицу времени. Константа хим. Равнов- определяется отношением скорости прямой реакции и обратной ракции. Природа раег.ве-в:- их состав, строение, взаимное влияние атом в неорганич и органич ве-вах- фактор, посредством которого сказывается влияние природы реаг.в-в на скорость реакции. Концентрация- чем больше концентраци реаг.ве-в, тем больше скорость химич. Реакции. Скорость пропорциональна произведению концентрации химич в-в, взятых в степени стехиометрич. Коэфф. Поверхность соприкосновения- это фактор связан с гетерогенными реакциями, кот протекают на поверхности соприкосновения реаг. Ве-в: газ-тв в-ва. Ф-ла выявления ср. скорости гетерогюр-ии при таком определении величин скорость гет.реакции не зависят от площади этой поверхности, те степени измельчения.
1.10 принцип Ле-Шателье: если на систему, наход в состояниии истинного химич. Равновесия оказать какое-либо воздейст.,то равновесие сместится в противоположную сторону. При повышении Т уравнение смещается в сторону эндотермич.р-ии. Активный комплекс- старые связи ен до конца разрушены, а новые не до конца сформировались. Е актив- минимальная энергия, которую нужно сообщить реагентам, чтобы они стали активными.
Не все молекулы могут перейти в состоянии активированного компл, тк для этого не достаточно простого сталкивания м-л, необходими, чтобы они ещё были активными- назваются мол-лы, Е кот. Больше или равна Е активир.комплекса.- та минимальная Е, которую нужно сообщить мол-лам, чтобы они стали активными.
В системе не все мол-лы реагентов обладают равным запасом Е, на диаграмме изображена Е средняя большинства мол-л в системе, есть так же мол-лы, Е<Есредней, Е >Е средней – это изображено граф. Максфера Больтсмана
При повышении Т повышается внетреняяЕ системы и доля активных ч-ц. Количественно зависимость скорости раекции от Т описывается в правиле Вант-Гоффа: при повышении Т на каждые 10 гр скорость ре-ции увелич в 2-4 раза. Католиз-увеличение скорости р-ции в присутствие в-в, принимающ. Участие только в промежут стадии протекания р-ии, но после выделяющ в таких же кол-вах и неизменном химич виде. Ингибиторы- в-ва, способные замедлять р-ии. Инициаторы- в-ва, способные зарождать цепные радикальные процессы, в результате распада или: р-ий образования свободных ардикалов. Гомогенный катализ Примером гомогенного катализа является разложение пероксида водорода в присутствии ионов йода. Реакция протекает в две стадии: H2О2 + I → H2О + IO H2О2 + IO → H2О + О2 + I При гомогенном катализе действие катализатора связано с тем, что он вступает во взаимодействие с реагирующими веществами с образованием промежуточных соединений, это приводит к снижению энергии активации. [править]Гетерогенный катализ При гетерогенном катализе ускорение процесса обычно происходит на поверхности твердого тела — катализатора, поэтому активность катализатора зависит от величины и свойств его поверхности. На практике катализатор обычно наносят на твердый пористый носитель. Механизм гетерогенного катализа сложнее, чем у гомогенного. Механизм гетерогенного катализа включает пять стадий, причем все они обратимы. Диффузия реагирующих веществ к поверхности твердого вещества Физическая адсорбция на активных центрах поверхности твердого вещества реагирующих молекул и затем хемосорбция их Химическая реакция между реагирующими молекулами Десорбция продуктов с поверхности катализатора Диффузия продукта с поверхности катализатора в общий поток Примером гетерогенного катализа является окисление SO2 в SO3 на катализаторе V2O5 при производстве серной кислоты (контактный метод).
1.12 Реакции: обратимые и необратимы. Для обратимых хар-но состояние химич равновесия-это такое стостояние, при котором скорости прямой и обратной р-ии равны и при этом не равны 0
В начальный момент времени ск. Прямой р-ии=0, тк ещё не продуктов р-ии. По мере прот.р-ии реагенты расходуются(скорость прямой уменьшается), продукты накапливаются(ск. Обратной увелич), таким образом наступает момент, когда скорости обратной и прямой равны.
Кр не зависит от концентрации и от катализатора. Кр- по ней можно судить куда смещено равновесие: Кр<<<1,то в сист больше реагентов, Кр>1,то больше прод.
Принцип Ле-Шателье: если на систему, наход в состояниии истинного химич. Равновесия оказать какое-либо воздейст.,то равновесие сместится в сторону ослабления оказанного воздействия. 1следств: при повышении концентрации одного из р. Равновесие сестится в ст. продуктов. 2след: при повеш Травновесие всегда смещ.в сторону эндотермич р-ии. 3 следств: Давление (только на газы) при повышении давления равновесие сместится в сторону уменьшения числа моль газа. 4следств: при разбавлении равновесия смещается в ст увелич числа частиц
|

 – тепловой эффект реакции образования одного моля вещества из простых веществ, его составляющих, находящихся в устойчивых стандартных состояниях.
– тепловой эффект реакции образования одного моля вещества из простых веществ, его составляющих, находящихся в устойчивых стандартных состояниях.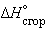 – тепловой эффект реакции сгорания одного моля вещества до образования высших оксидов. Для органических веществ – до
– тепловой эффект реакции сгорания одного моля вещества до образования высших оксидов. Для органических веществ – до  и
и  . Теплота сгорания негорючих веществ принимается равной нулю. Теплота сгорания топлива характеризует его теплотворную способность. Закон Гесса: дельта Н реакции зависит только от нач и конечного с. Си-мы, и не зависит от пути её перехода.
. Теплота сгорания негорючих веществ принимается равной нулю. Теплота сгорания топлива характеризует его теплотворную способность. Закон Гесса: дельта Н реакции зависит только от нач и конечного с. Си-мы, и не зависит от пути её перехода.


