Степени окисления фосфора, серы, хлора
Для большинства элементов главных подгрупп высшая степень окисления равна номеру группы, в которой находится элемент, а низшая степень окисления равна разности N–8, (N – номер группы). Ответ на вопрос задачи см. в табл. 3.1. Пример 4.2. На каком основании марганец и бром расположены в одном периоде (4), одной VII группе, но в разных подгруппах – А и В? Решение. Электронная конфигурация атомов марганца и брома соответственно – 25Mn [Ar]3 d 54 s 2; 35Br [Ar]4 s 24 p 5. Количество заполняющихся энергетических уровней в атомах указанных элементов равно 4, значит, это элементы 4 периода. Сумма валентных электронов у каждого атома равна 7, следовательно, это элементы VII группы. Но валентные электроны атома марганца расположены на 4 s -подуровне внешнего и d -подуровне предвнешнего уровня, значит, это d -элемент и расположен в побочной подгруппе (В). Валентные электроны атома брома находятся на p- и s- подуровнях внешнего уровня. Следовательно, это p- элемент и расположен в главной подгруппе (А). Пример 4.3. У какого из элементов четвертого периода – ванадия или мышьяка – сильнее выражены металлические свойства? Какой из этих элементов образует газообразное соединение с водородом? Решение. Электронные конфигурации атомов данных элементов 23V [Ar]3 d 34 s 2; 33As [Ar]4 s 24 p 3. Ванадий – d- элемент VB-группы, а мышьяк – p- элемент VA-группы. На внешнем энергетическом уровне у атома ванадия два электрона, а у атома мышьяка – пять. Принадлежность элемента к металлам или неметаллам определяется, в основном, числом электронов на внешнем энергетическом уровне. Атомы металлов на внешнем уровне содержат 1–2, реже 3 электрона. Металлы проявляют только восстановительные свойства и, отдавая свои электроны, переходят в положительно заряженные ионы. Отрицательно заряженных ионов металлы не образуют. Атомы неметаллов на внешнем энергетическом уровне имеют 4–7 электронов. Они могут как принимать электроны (т. е. выступать в качестве окислителей), так и отдавать электроны (т. е. быть восстановителями) У неметаллов окислительная функция выражена сильнее, чем восстановительная. Атомы неметаллов образуют отрицательно заряженные ионы. Таким образом, ванадий, как и все металлы, обладает только восстановительными свойствами, тогда как для мышьяка более свойственны окислительные функции. Общей закономерностью для всех групп, содержащих р- и d- элементы, является преобладание металлических свойств у d- элементов. Следовательно, металлические свойства у ванадия выражены сильнее, чем у мышьяка. Газообразное соединение с водородом образует неметалл мышьяк (As–3H3). Пример 4.4. Вычислите молярную массу и назовите элемент, высший оксид которого отвечает формуле ЭО3, образует с водородом газообразное соединение, массовая доля водорода в котором 1,54%. Решение. Вычислим содержание элемента в гидриде, приняв массу гидрида за 100%: 100 – 1,54 = 98,46%, т. е. на 98,46 частей массы элемента приходится 1,54 частей массы водорода или на 98,46 г элемента приходится 1,54 г водорода. Зная, что молярная масса эквивалентов водорода равна 1 г/моль, определим молярную массу эквивалентов элемента в гидриде по закону эквивалентов:
Элемент образует высший оксид ЭО3, следовательно, он находится в VI группе. Его высшая степень окисления в соединении с кислородом +6, а низшая – в соединении с водородом –2. Находим молярную массу элемента из соотношения
Задачи 61. Исходя из положения марганца, рубидия, мышьяка в периодической системе, составьте формулы оксидов, отвечающих их высшей степени окисления, и соответствующих им гидроксидов. 62. У какого из р -элементов VII группы – хлора или иода – сильнее выражены неметаллические свойства? Почему? Исходя из высшей степени окисления элементов, напишите формулы кислородсодержащих кислот. Какая из них более сильная? 63. У какого элемента пятого периода – молибдена или теллура – сильнее выражены металлические свойства? Ответ мотивируйте, записав электронные конфигурации атомов этих элементов. Какой из них образует газообразное соединение с водородом? Составьте формулу этого соединения. 64. Исходя из положения металла в периодической системе, дайте мотивированный ответ на вопрос: какой из двух гидроксидов более сильное основание: а) Mg(OH)2 или Ba(OH)2; б) Ca(OH)2 или Co(OH)2; в) Ca(OH)2 или Zn(OH)2? Напишите уравнения реакций, доказывающих амфотерность гидроксида цинка. 65. Один из элементов III группы образует оксид с массовой долей кислорода 25,6%. Рассчитайте молярную массу элемента и назовите этот элемент. (Ответ: 69,7 г/моль). 66. Марганец образует соединения, в которых он проявляет степени окисления +2, +3, +4, +6, +7. Составьте формулы его оксидов и гидроксидов, отвечающих этим степеням окисления. 67. Что называется энергией ионизации? Как изменяется восстановительная активность элементов в главных и побочных подгруппах периодической системы с увеличением порядкового номера? Почему? Значения энергии ионизации элементов I группы соответственно равны Li – 5,4; Cs – 3,9; Cu – 7,7; Au – 9,2 эВ. У элементов какой подгруппы восстановительные свойства выражены более резко? 68. Назовите элемент по следующим данным: а) элемент 4 периода, высший оксид Э2О7, с водородом образует газообразное соединение НЭ; б) элемент 5 периода, высший оксид ЭО2, с водородом газообразных соединений не образует; в) элемент 4 периода, высший оксид ЭО, с водородом дает солеобразное соединение ЭН2. 69. Исходя из положения элемента в периодической системе, дайте мотивированный ответ на вопрос: как изменяется сила кислот в рядах: а) H2SO4→H2SeO4→H2TeO4; б) H4SiO4→H3PO4→H2SO4→HСlO4? 70. Что называется сродством к электрону? Как изменяется окислительная активность неметаллов в периоде и в группе периодической системы с увеличением порядкового номера? Какой из атомов – хлор или йод – является окислителем при образовании молекулы ICl из атомов? 71. Вычислите массовую долю (в %) элементов в высших оксидах: а) селена; б) рения; в) осмия; г) индия. (Ответ: 62,2%; 76,9%; 74,8%; 82,7%). 72. Составьте формулы оксидов и гидроксидов элементов третьего периода, отвечающих их высшей степени окисления. Как изменяется кислотно-основной характер этих соединений при переходе от натрия к хлору? Напишите уравнения реакций, доказывающих амфотерность гидроксида алюминия. 73. Почему элементы №39 и №49 расположены в одном периоде (5), одной III группе, но разных подгруппах – А и В? 74. Вычислите молярную массу и назовите элемент, высший оксид которого отвечает формуле Э2О5, образует с водородом газообразное соединение, массовая доля водорода в котором 8,82%. (Ответ: 31 г/моль). 75. Напишите формулы высших оксидов и их гидроксидов для элементов с порядковыми номерами 4; 37; 75. Напишите уравнения реакций, доказывающих амфотерный характер гидроксида бериллия. 76. Какие водородные соединения образуют р- элементы третьего периода? Как изменяются кислотные свойства этих соединений в периоде слева направо? 77. Исходя из степени окисления атомов соответствующих элементов, дайте мотивированный ответ на вопрос: какой из двух гидроксидов является более сильным основанием: а) Cr(OH)2 или Cr(OH)3; б) CuOH или Cu(OH)2; в) Fe(OH)2 или Fe(OH)3? 78. Какую низшую степень окисления проявляют кремний, азот, селен, бром? Составьте формулы соединения магния с данными элементами в этой их степени окисления. 79. Исходя из положения элементов в периодической системе и их степеней окисления, дайте мотивированный ответ, какой из оксидов должен быть более сильным окислителем: а) CrO3 или WO3? б) B2O3 или Tl2O3? 80. Какую низшую и высшую степени окисления проявляют углерод, мышьяк, теллур и йод? Составьте формулы соединений данных элементов, отвечающих этим степеням окисления.
5. Химическая связь и строение молекул Все вещества образуются в результате возникновения между атомами, входящими в их состав, прочных связей, называемых химическими. Химическая связь осуществляется в результате электростатического взаимодействия положительно заряженных атомных ядер и отрицательно заряженных электронов, а также электронов друг с другом. Различают три основных вида химической связи – ионная, ковалентная и металлическая. В чистом виде каждый из перечисленных видов связи встречается крайне редко. Кроме основных видов связи существуют различные типы межмолекулярных взаимодействий – вандерваальсовы взаимодействия (диполь-дипольное, индукционное, дисперсионное), водородная связь и др. Строение и свойства молекул или других частиц характеризуются рядом параметров химической связи – энергией связи, длиной связи (межатомные расстояния), валентным углом (угол между воображаемыми прямыми, проходящими через ядра атомов). Химическая связь образуется только в том случае, если при сближении атомов (двух или более) полная энергия системы (сумма кинетической и потенциальной энергий) понижается. Количество энергии, выделяющееся при образовании химической связи, называется энергий связи и измеряется в кДж/моль. Энергия связи является мерой ее прочности – чем выше энергия связи, тем прочнее молекула, тем ниже длина связи. Так, например, расстояние между ядрами водорода и кислорода в молекуле воды составляет 0.096 нм, угол Н-О-Н – 104.5о, а энергия связи Н-О 462 кДж/моль. Ионная химическая связь образуется в результате электростатического взаимодействия отрицательно и положительно заряженных ионов. Условием образования ионной связи является большая разность в значениях электроотрицательности атомов, образующих молекулу. Считается, что ионная связь образуется между элементами, разность в электроотрицательности которых достигает или превышает 2.0. К наиболее типичным соединениям с ионной связью относятся галогениды щелочных и щелочноземельных металлов. При образовании ионной связи атомы стремятся отдать или принять такое число электронов, чтобы строение их внешней электронной оболочки оказалось аналогичным строению ближайшего к ним инертного газа (восемь электронов на внешнем энергетическом уровне). Например, хлорид натрия (NaC1) состоит из катионов Na+ и анионов C1-, которые являются продуктами в результате окисления атомов натрия и восстановления атомов хлора: Na - 1ē = Na+ (1s22s22p6) Cl + 1ē = Cl- (1s22s22p63s23p6) При обычных условиях ионные соединения представляют собой кристаллические вещества. В кристаллической решетке ионных соединений ион одного знака окружен определенным количеством ионов противоположного знака, число которых определяется соотношением ионного радиуса. Каждый ион притягивает к себе ионы противоположного знака в любом направлении. Так, в кристалле NaC1 каждый ион натрия окружен шестью ионами хлора, также как и каждый ион хлора окружен шестью ионами натрия. Поэтому, ионная связь характеризуется ненаправленностью и ненасыщаемостью. В молекулах, образованных атомами с близкими значениями электроотрицательности, реализуется ковалентная связь. Ковалентная связь образуется путем обобществления пары электронов двумя атомами. В образовании ковалентной связи принимают участие так называемые «валентные» электроны – электроны внешней оболочки атома. В случае образования двухатомной молекулы, например Н2, сближение двух атомов приводит к взаимному проникновению их атомных орбиталей друг в друга. При этом электронная плотность в межъядерном пространстве увеличивается и способствует притяжению ядер. Ядра атомов притягиваются друг к другу, энергия системы понижается. Расстояние между ядрами имеет оптимальное значение, характеризуемое длиной связи. Сближение ядер на более близкое расстояние приводит к их взаимному отталкиванию.
Н Н Н2 При образовании молекулы между одинаковыми атомами (молекулы водорода, кислорода, азота, хлора) область максимального перекрывания атомных орбиталей находится на одинаковом расстоянии от обоих ядер. Такая связь называется ковалентной неполярной связью. В таких молекулах электронная пара в одинаковой мере принадлежит обоим атомам. К неполярным относятся любые двухатомные гомоядерные молекулы – Н2, N2, О2, F2, С12, Br2, I2 и др. В случае, когда в образовании связи принимают участие разные атомы (с разной электроотрицательностью), электронная плотность смещена к более электроотрицательному атому. Такая связь называется ковалентной полярной связью. Примером молекул с такой связью могут служить галогеноводороды (НС1, НBr, HI), вода, сероводород (H2S), аммиак (NH3), оксиды углерода (CO, CO2) и др. Ковалентная связь характеризуется насыщаемостью и направленностью. Направленность выражается значениями валентных углов, насыщаемость определяется количеством электронов и АО, способных участвовать в образовании связи. Структура и свойства молекул с ковалентной связью объясняется с позиций метода валентных связей (ВС) и метода молекулярных орбиталей (ММО). 1. По методу ВС химическая связь между двумя атомами возникает в результате перекрывания атомных орбиталей (АО) с образованием электронных пар. 2. Образованная электронная пара локализована между двумя атомами. Такая связь является двухцентровой и двухэлектронной. 3. Химическая связь образуется только при взаимодействии электронов с антипараллельными спинами. 4. Характеристики химической связи (энергия, длина, полярность, валентные углы) определяется типом перекрывания АО. 5. Ковалентная связь направлена в сторону максимального перекрывания АО реагирующих атомов. В образовании ковалентной связи могут принимать участие АО как одинаковой, так и различной симметрии. При перекрывании АО вдоль линии соединения атомов образуется s-связь.
s-s s-p p-p d-d При перекрывании АО по обе стороны от линии соединения атомов образуется p-связь.
p-p p-d d-d При перекрывании всех четырех лопастей d-АО, расположенных в параллельных плоскостях, образуется d-связь. Примеры образования молекул по методу ВС. В молекуле фтора F2 связь образована 2р-орбиталями атомов фтора:
В молекуле фтороводорода НF связь образована 1s-орбиталью атома водорода и 2р-орбиталью атома фтора:
Гибридизация атомных орбиталей. Для объяснения строения некоторых молекул в методе ВС применяется модель гибридизации атомных орбиталей (АО). У некоторых элементов (бериллий, бор, углерод) в образовании ковалентных связей принимают участие как s-, так и p-электроны. Эти электроны расположены на АО, различающихся по форме и энергии. Несмотря на это связи, образованные с их участием, оказываются равноценными и расположены симметрично. В молекулах ВеС12, ВС13 и СС14, например, валентный угол С1ЭС1 равен 180, 120, и 109.28о. Значения и энергии длин связей Э-С1 имеют для каждой из этих молекул одинаковое значение. Принцип гибридизации орбиталей состоит в том, что исходные АО разной формы и энергии при смешении дают новые орбитали одинаковой формы и энергии. Тип гибридизации центрального атома определяет геометрическую форму молекулы или иона, образованного им. Рассмотрим с позиций гибридизации атомных орбиталей строение ряда молекул.
Рассмотрим с позиций гибридизации молекулу ацетилена С2Н2. В молекуле ацетилена каждый атом углерода находится в sp-гибридном состоянии, образуя две гибридные связи, направленные под углом 180° друг к другу. Как в случае связей С-С, так и в случае связей С-Н возникает общее двухэлектронное облако, образующее σ-связи. Но в молекуле ацетилена в каждом из атомов углерода содержится еще по два р-электрона, которые не принимают участия в образовании σ-связей. Молекула ацетилена имеет плоский линейный «скелет», поэтому оба р-электронных облака в каждом из атомов углерода выступают из плоскости молекулы в перпендикулярном к ней направлении. При этом происходит также некоторое взаимодействие электронных облаков, но менее сильное, чем при образовании σ-связей. В итоге в молекуле ацетилена образуются еще две ковалентные углерод-углеродные связи, называемые p-связями.
Метод молекулярных орбиталей (МО). В основе метода молекулярных орбиталей лежит положение о том, что при образовании химической связи атомные орбитали атомов утрачивают свою индивидуальность. В результате комбинации этих атомных орбиталей возникают молекулярные орбитали сложной формы, принадлежащие всей молекуле в целом, т. е. являющиеся многоцентровыми. Образование молекулярных орбиталей из атомных изображают в виде энергетических диаграмм, где по вертикали откладывают значения энергии. Комбинация АО приводит к двум типам МО. Связывающие МО характеризуются повышенной концентрацией электронной плотности между ядрами атомов и более низким уровнем энергии (в сравнении с исходными АО). Нахождение электронов на таких орбиталях энергетически выгодно и приводит к образованию связи. Разрыхляющие МО характеризуются пониженной концентрацией электронной плотности между ядрами и более высоким уровнем энергии (в сравнении с исходными АО). Нахождение электронов на таких орбиталях энергетически невыгодно и не приводит к образованию связи. Разрыхляющие МО иначе называют антисвязывающими. Заполнение МО осуществляется в порядке возрастания энергии и согласуется с принципом Паули и правилом Гунда. С позиций метода МО возможно объяснение образования химической связи для частиц с одним электроном, например, Н2+. Возможность и невозможность образования простейших двухатомных молекул по методу МО можно рассмотреть на примере Н2 и Не2.
Для оценки прочности связи в методе МО введен параметр, называемый порядком связи. Порядок связи рассчитывается как полуразность суммы электронов на связывающих и разрыхляющих орбиталях. Чем выше значение порядка связи, тем прочнее молекула и выше энергия связи. Так, в молекуле Н2 порядок связи равен 1. В молекуле Не2 (порядок связи равен нулю, это означает, что такая молекула не существует, так как при ее образовании энергия системы не изменяется.
Примеры решения задач Пример 5.1. Определите, как изменяется прочность соединений в ряду: HF, НСl, НВr, HI. Решение. У этих двухатомных молекул прочность связи зависит от длины связи. А поскольку радиус атома при переходе от фтора к иоду возрастает, то длина связи Н - галоген в этом направлении возрастает, т.е. прочность соединений при переходе от фтора к иоду уменьшается. Пример 5.2. В какой из приведенных молекул валентный угол между химическими связями равен 120o: H2O, CO2, CH4, BF3, BeCl2, NH3? Решение. Значение валентного угла в каждой из этих молекул определяется типом гибридизации АО центрального атома. В молекулах H2O, CH4, и NH3 валентные электроны у атомов кислорода, углерода и азота расположены на sp3-гибридных АО, в молекулах CO2 и BeCl2 на sp-гибридных АО, а в молекуле BF3 sp2-гибридные АО атома бора расположены в пространстве под углом 120o и образуют плоский треугольник. Пример 5.3. Определите тип химической связи (ионная, ковалентная неполярная, ковалентная полярная) в приведенных соединениях: N2, CO, NaF, O2, HCl, CO2, PH3, КС1. Решение. Молекулы N2 и O2, состоящие из одинаковых атомов (гомоядерные) неметаллов, образованы ковалентной неполярной связью. Гетероядерные молекулы CO, HCl, CO2 и PH3, образованы неметаллами, разность в значениях электроотрицательности для которых составляет менее 2.0, следовательно, в них реализуется ковалентная полярная связь. Кристаллические соединения фторид натрия NaF и хлорид калия КС1 образованы катионами щелочных металлов и галоген-анионами. Это соединения с типично ионным характером химической связи. Пример 5.4. Какие орбитали участвуют в образовании химических связей в молекулах HF, NO, H2S, N2? Решение. В образовании химических связей принимают участие валентные электроны. Запишем электронные формулы атомов, образующих предложенные молекулы: H 1s1, C 1s22s22p2, N 1s22s22p3, F 1s22s22p5, S 1s22s22p63s23p4. Следовательно, в образовании молекулы HF принимают участие 1s-орбиталь атома водорода и 2р-орбиталь атома фтора, в образовании молекулы NO участвуют 2р-орбитали атомов азота и кислорода, молекула H2S образована 1s-орбиталью атомов водорода и двумя 3р-орбиталями атома серы, а молекула N2 2р-орбиталями двух атомов азота. Пример 5.5. Расположите в ряд по увеличению прочности связи следующие молекулы: N2, CO, F2. Определите порядок связи в этих молекулах в соответствии с методом молекулярных орбиталей. Решение. Прочность связи по методу МО возрастает при увеличении порядка связи. Порядок связи рассчитывается как полуразность электронов на связывающих и разрыхляющих орбиталях. В предложенных двухатомных молекулах в образовании молекулярных орбиталей принимают участие по три 2р-атомные орбитали каждого из атомов, всего шесть АО.
прочность молекул увеличивается в обратной последовательности F2®CO®N2. Задачи 81. Укажите тип химической связи в молекулах НBr, Br2, H2. Приведите схему перекрывания атомных орбиталей. 82. Объясните с позиций метода молекулярных орбиталей возможность или невозможность существования устойчивых двухатомных молекул О2, He2, Cl2. Рассчитайте значение порядка связи для каждой из молекул. 83. Определите тип химической связи в следующих соединениях: KBr, I2, SO3, S8, NO. 84. Определите тип гибридизации атомов кремния в соединениях SiH4 и SiO2. 85. В каком из приведенных соединений валентный угол, образованный атомными орбиталями атома углерода, близок к 109о: СО, СС14, СS2? 86. Перекрывание каких орбиталей обеспечивает образование нижеперечисленных молекул: SiH4, NO, HI? 87. Изобразите энергетические диаграммы образования молекул СО и НС1 по методу молекулярных орбиталей. 88. Изобразите перекрывание атомных орбиталей при образовании молекулы N2 по методу валентных связей при условии, что между атомами азота существует тройная связь. 89. Какую геометрическую форму имеет молекула хлороформа СНС13? Изобразите перекрывание атомных орбиталей при образовании данной молекулы. Определите тип гибридизации атома углерода. 90. Сопоставьте прочность связи в молекулах О2 и С12. Определите порядок связи в этих молекулах в соответствии с методом молекулярных орбиталей. 91. Укажите тип химической связи в молекулах Н2О, HBr, N2. Приведите схему перекрывания атомных орбиталей. 92. Объясните с позиций метода молекулярных орбиталей невозможность существования устойчивых двухатомных молекул He2 и Ne2. 93. Определите тип гибридизации атомов углерода в соединениях С2H6 и СO2. 94. В каком из приведенных соединений валентный угол, образованный атомными орбиталями атома, углерода близок к 180о: СО2, СС14, С2Н4? 95. Перекрывание каких орбиталей обеспечивает образование нижеперечисленных молекул: SiCl4, NO, HBr? 96. Сопоставьте прочность связи в молекулах СО и NO. Определите порядок связи в этих молекулах в соответствии с методом молекулярных орбиталей. 97. Определите тип химической связи в следующих соединениях: СsС1, Br2, NO2, P4, H2O2. 98. Какую геометрическую форму имеет молекула четыреххлористого углерода СС14? Изобразите перекрывание атомных орбиталей при образовании данной молекулы. Определите тип гибридизации атома углерода. 99. Изобразите перекрывание атомных орбиталей при образовании молекулы С12 по методу валентных связей. 100. Определите порядок связи по методу молекулярных орбиталей в двухатомных гомоядерных молекулах N2, О2 и С12. 6. Энергетика и направление химических процессов Химические реакции сопровождаются выделением или поглощением теплоты. Реакции, протекающие с выделением теплоты в окружающую среду, называются экзотермическими, а с поглощением теплоты – эндотермическими. Количество теплоты, которое выделяется или поглощается при химической реакции, называется тепловым эффектомреакции. Тепловой эффект реакции, протекающей в условиях р=const, T=const, равен изменению энтальпии системы ∆Н и измеряется в кДж. При экзотермической реакции энтальпия системы уменьшается и ∆Н < 0, а при эндотермической – энтальпия системы увеличивается и ∆Н > 0. Если исходные вещества и продукты реакции находятся в стандартном состоянии, то энтальпию реакции называют стандартной и обозначают ∆Н0 или ∆Н0298. Верхний индекс отвечает стандартному давлению (101кПа), нижний индекс соответствует стандартной температуре, принятой по международному соглашению, равной 298 К. Уравнения химических реакций, в которых указаны изменения энтальпии (тепловые эффекты реакций), называются термохимическими. Например, термохимическое уравнение N2(г) + 3Н2 (г) = 2NH3 (г), ∆Н0х.р = –92, 4 кДж. показывает, что при взаимодействии 1 моль N2 и 3 моль Н2 образуется 2 моль NH3 и выделяется количество теплоты, равное 92, 4 кДж. В основе термохимических расчетов лежит закон Гесса: тепловой эффект химической реакции зависит только от начального и конечного состояний веществ и не зависит от промежуточных стадий процесса. Часто в термохимических расчетах применяют следствие из закона Гесса: энтальпия химической реакции равна сумме энтальпий образования продуктов реакции за вычетом суммы энтальпий образования исходных веществ с учетом стехиометрических коэффициентов реакции. Например, стандартная энтальпия реакции aA+bB=сС+dD определяется по формуле ∆Н0х.р =(с∆ f Н0С+ d∆ f Н0D) – (a∆ f Н0A+ b∆ f Н0B), где ∆ f Н0 – стандартная энтальпия образования соединения. Стандартной энтальпией образования называется стандартная энтальпия реакции образования 1 моль сложного вещества из простых веществ, устойчивых при 298 К и давлении 101 кПа. Обозначается ∆ f Н0298или ∆ f Н0 (температуру 298 К можно опустить), измеряется в кДж/моль. ∆ f Н0 простых веществ равна нулю. Направление протекания химической реакции определяет энергия Гиббса (∆G). При р=const, T=const реакция самопроизвольно протекает в том направлении, которому отвечает убыль энергии Гиббса. Если ∆G < 0, то реакциясамопроизвольно протекает в прямом направлении. Если ∆G > 0, то самопроизвольное протекание процесса в прямом направлении невозможно. Если ∆G = 0, то реакция может протекать как в прямом направлении, так и в обратном, и система находится в состоянии равновесия.Изменение ∆Gх.р не зависит от пути процесса и может быть рассчитано по следствию из закона Гесса: изменение энергии Гиббса в результате химической реакции равно сумме энергий Гиббса образования продуктов реакции за вычетом суммы энергий Гиббса образования исходных веществ с учетом стехиометрических коэффициентов. Например, стандартная энергия Гиббса реакции aA + bB = сС + dD: ∆G0х.р. = (с∆ f G0С + d∆ f G0D) – (a∆ f G0A + b∆ f G0B), где ∆ f G0 – стандартная энергия Гиббса образования вещества, кДж/моль. Энергия Гиббса образования простых веществ равна нулю. ∆G0х.р имеет ту же размерность, что и энтальпия, и поэтому обычно выражается в кДж. Изменение стандартной энергии Гиббса химической реакции может быть также вычислено по уравнению ∆G0х.р. = ∆Н0х.р – Т∆S0х.р. , где Т – абсолютная температура, ∆S0х.р. – изменениеэнтропии. Энтропия – это мера неупорядоченности состояния системы; стремление частиц (молекул, ионов, атомов) к хаотическому движению, а системы – к переходу от более упорядоченного состояния к менее упорядоченному. Энтропия возрастает с увеличением движения частиц при нагревании, испарении, плавлении, расширении газа, при ослаблении или разрыве связей между атомами и т.п. Процессы, связанные с упорядоченностью системы (конденсация, кристаллизация, сжатие, упрочнение связей, полимеризация), сопровождаются уменьшением энтропии. Измеряется энтропия в Дж/моль×К. Изменение энтропии системы в результате протекания химической реакции (∆S) (энтропия реакции) равно сумме энтропий продуктов реакции за вычетом суммы энтропий исходных веществ с учетом стехиометрических коэффициентов. Изменение энтропии в результате протекания химической реакции aA + bB = сС + dD ∆S0х.р.= (сS0С + dS0D ) – (aS0A + bS0 B). При химическом взаимодействии одновременно изменяется энтальпия, характеризующая стремление системы к порядку, и энтропия, характеризующая стремление системы к беспорядку. Если тенденции к порядку и беспорядку в системе одинаковы, то ∆H0х.р. = Т∆S0х.р., что является условием равновесного состояния системы. Если пренебречь изменениями ∆H0х.р. и ∆S0х.р с увеличением температуры, то можно определить температуру, при которой устанавливается равновесие химической реакции для стандартного состояния реагентов: Травн. =
|

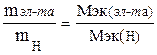 ;
;  ; Мэк (эл-та) = 63,9 г/моль.
; Мэк (эл-та) = 63,9 г/моль. . М = 63,9×2 = 127,8 г/моль. Следовательно, искомая молярная масса элемента 127,8, а элемент – теллур.
. М = 63,9×2 = 127,8 г/моль. Следовательно, искомая молярная масса элемента 127,8, а элемент – теллур.






 ЛИНЕЙНАЯ
МОЛЕКУЛА
ЛИНЕЙНАЯ
МОЛЕКУЛА









 Образование молекулы N2 по методу МО
Образование молекулы N2 по методу МО
 .
.


