КІНЕТИКА ХІМІЧНИХ РЕАКЦІЙ У РОЗЧИНАХ3 ДСТУ Метрология. Термины и определения. 4 ГОСТ 8.009—84. ГСИ. Нормируемые метрологические характеристики средств измерений.
Фізична хімія Хімічна кінетика. Електрохімія Методичні вказівки до виконання лабораторних робіт для студентів напряму підготовки 6.051301 «Хімічна технологія» усіх форм навчання Рекомендовано Вченою радою хіміко-технологічного факультету НТУУ «КПІ»
Київ НТУУ «КПІ» Фізична хімія. Хімічна кінетика. Електрохімія [Текст]: метод. вказівки до викон. лаборатор. робіт для студ. напряму підготов. 6.051301 «Хімічна технологія» усіх форм навчання / Уклад.: Г.А. Рудницька, Т.А. Каменська, Т.В. Кірсенко. – К.: НТУУ «КПІ», 2012. – 76 с. – 120 пр. Рекомендовано Вченою радою ХТФ НТУУ «КПІ» (Протокол № 1 від 30 січня 2012 р.)
Н а в ч а л ь н е в и д а н н я
Фізична хімія Хімічна кінетика. Електрохімія Методичні вказівки до виконання лабораторних робіт для студентів напряму підготовки 6.051301 «Хімічна технологія» усіх форм навчання
Укладачі: Рудницька Ганна Анатоліївна,канд. хім. наук, доц. Каменська Тетяна Анатоліївна,канд. хім. наук, доц. Кірсенко Тетяна Володимирівна, канд. хім. наук, доц.
Відповідальний редактор М.Є. Пономарьов, канд. хім. наук, доц.
Рецензент Т.І. Дуда, канд. хім. наук, доц.
За редакцією укладачів Надруковано з оригінал-макета замовника
ВСТУП Значна роль в опануванні теоретичними основами курсу фізичної хімії та в ознайомленні з різними фізико-хімічними методами дослідження хімічних систем належить лабораторним заняттям. Лабораторний практикум є однією з найважливіших ланок навчально-методичного процесу засвоєння природничо-наукової дисципліни. Виконуючи лабораторні завдання, студенти набувають навичок експериментальної роботи, навчаються самостійно обробляти та аналізувати дослідні дані, робити за отриманими результатами висновки і узагальнення. Дані методичні вказівки створено на базі багаторічних методичних розробок викладачів кафедри фізичної хімії Національного технічного університету України «КПІ» у відповідності до діючої робочої навчальної програми кредитного модуля «Фізична хімія 2. Хімічна кінетика. Електрохімія» для студентів напряму підготовки 6.051301 «Хімічна технологія» всіх спеціальностей. Опис кожної лабораторної роботи містить стислі теоретичні відомості. Однак для більш глибокого та усвідомленого засвоєння певної теми студент повинен готуватися до лабораторного заняття за конспектом лекцій та за підручниками, посилання на які наведено після кожної роботи. Підготовка до виконання лабораторного практикуму крім засвоєння теоретичного матеріалу передбачає також написання протоколу, в якому обов’язково зазначається назва роботи, її мета, описується хід виконання, а у звіті наводяться таблиці для запису експериментальних даних. Для допуску до виконання кожної лабораторної роботи та її захисту необхідно опрацювати контрольні запитання до відповідної теми, які наведено в методичних вказівках [8]. Всі розрахунки, які виконуються на основі експериментальних та довідникових даних, повинні бути представлені у протоколі. Їх результати скорочуються до певної кількості значущих цифр, що відповідають точності досліду. Необхідно зазначати розмірність кожної обчисленої величини. Графіки будують у правильно вибраному масштабі на міліметровому папері або за допомогою комп’ютера. У багатьох випадках експериментальне значення певної властивості порівнюють з теоретичним, обчислюючи відносну похибку експерименту за формулою:
де Перед початком роботи в лабораторіях кафедри фізичної хімії кожен студент проходить інструктаж з питань охорони праці та протипожежної безпеки, що відображено у відповідному журналі реєстрації. Крім того, безпосередньо перед виконанням лабораторної роботи викладач нагадує студентам про необхідність дотримання загальних заходів безпеки та тих, що відповідають особливостям виконуваної роботи. КІНЕТИКА ХІМІЧНИХ РЕАКЦІЙ У РОЗЧИНАХ Миттєва або істинна швидкість хімічної реакції за окремим компонентом за умови сталого об’єму системи визначається як зміна концентрації будь-якого учасника реакції i у певний нескінченно малий проміжок часу, тобто як похідна концентрації цього компоненту по часу:
Швидкість реакції завжди додатна. Якщо її визначають за продуктом реакції Згідно із законом діючих мас, швидкість гомогенної реакції пропорційна добутку концентрацій речовин, які вступають до реакції, з певними показниками степенів. Вираз, що описує залежність швидкості реакції від концентрацій реагентів, називається кінетичним рівнянням реакції. Якщо деяка реакція
де Якщо реакція, загальний вигляд якої наведено вище, є складною, тобто багатостадійною, то кінетичне рівняння набуває вигляду:
У даному випадку показники степенів, до яких піднесені концентрації вихідних речовин, зазвичай не збігаються зі стехіометричними коефіцієнтами. Загальний порядок реакції Молекулярність є характеристикою простої реакції або окремої стадії складного хімічного процесу. Вона визначається числом частинок, що беруть участь у елементарному акті хімічної взаємодії. Існують моно-, бі- та (рідко) тримолекулярні реакції. Молекулярність не може бути більшою за три, оскільки одночасне зіткнення чотирьох та більше частинок є вкрай малоймовірним. Для простої реакції порядок та молекулярність збігаються тоді, коли реагенти взято у стехіометричному співвідношенні. Якщо ж один з них міститься у надлишку, то молекулярність реакції не змінюється, а загальний порядок зменшується на величину частинного порядку за компонентом з надлишковою концентрацією. Якщо складна реакція перебігає через ряд послідовних стадій, то її швидкість визначається швидкістю найповільнішої стадії, яку називають лімітуючою. Константи швидкості реакцій різних порядків обчислюють за рівняннями:
де Порядок реакції за певним компонентом (частинний порядок) визначають на основі експериментальних даних про зміну концентрації цієї речовини з часом. Досліджуючи частинний порядок реакції за певним компонентом, всі інші реагенти беруть у надлишку. Внаслідок цього їх концентрації в ході досліду практично не змінюються і можуть бути включені до величини константи швидкості реакції. Таким чином, надлишок одного або декількох реагентів призводить до зменшення загального порядку реакції на суму частинних порядків за тими речовинами, концентрації яких є надлишковими. Методи визначення частинних порядків поділяють на інтегральні та диференціальні. В інтегральних методах порядок визначають на основі експериментальних залежностей концентрацій речовин або інших, пропорційних концентраціям властивостей, від часу. В диференціальних методах застосовують залежності миттєвої швидкості за компонентом від його концентрації. Для визначення частинного порядку реакції, наприклад, на основі методу підстановки, який належить до інтегральних Часом напівперетворення Внаслідок підвищення температури швидкість переважної більшості реакцій зростає. Згідно з правилом Вант-Гоффа внаслідок збільшення температури на 10 градусів швидкість гомогенної реакції зростає приблизно у 2 – 4 рази. Температурний коефіцієнт швидкості реакції визначають як:
де Якщо відомо константи швидкості для будь-яких двох температур, то
Температурний коефіцієнт Значно краще залежності швидкості та константи швидкості реакції від температури описує рівняння Арреніуса, диференціальна форма якого має вигляд:
а інтегральна за умови
В рівняннях (1.10) та (1.11)
Інтегральну форму рівняння Арреніуса (1.10) за умови
де
Для більшості гомогенних реакцій енергія активації лежить у межах 50 – 200 кДж/моль.
|

 ,
, і
і  – експериментальне та теоретичне значення, відповідно. Дослід можна вважати якісним, якщо відносна похибка не перевищує 10 %.
– експериментальне та теоретичне значення, відповідно. Дослід можна вважати якісним, якщо відносна похибка не перевищує 10 %. . (1.1)
. (1.1) , то в рівнянні (1.1) ставлять знак
, то в рівнянні (1.1) ставлять знак  , якщо за вихідною речовиною
, якщо за вихідною речовиною 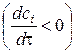 – знак "–".
– знак "–".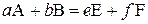 є простою (елементарною), тобто перебігає в одну стадію, то кінетичне рівняння має вигляд:
є простою (елементарною), тобто перебігає в одну стадію, то кінетичне рівняння має вигляд: , (1.2)
, (1.2) – константа швидкості реакції, яка чисельно дорівнює швидкості процесу за умови одиничних концентрацій реагентів; a і b – частинні порядки за компонентами А та В, відповідно. Для простої реакції частинні порядки мають такі самі значення, що й стехіометричні коефіцієнти реагентів у рівнянні реакції.
– константа швидкості реакції, яка чисельно дорівнює швидкості процесу за умови одиничних концентрацій реагентів; a і b – частинні порядки за компонентами А та В, відповідно. Для простої реакції частинні порядки мають такі самі значення, що й стехіометричні коефіцієнти реагентів у рівнянні реакції. . (1.3)
. (1.3) – це сума частинних порядків, а саме: для рівняння (1.2)
– це сума частинних порядків, а саме: для рівняння (1.2)  , а для виразу (1.3)
, а для виразу (1.3)  . Порядок реакції може бути цілим, дробовим та нульовим. Частинні порядки іноді набувають навіть від’ємних значень. Порядок реакції не залежить від часу, концентрацій реагентів (якщо немає значного надлишку одного або декількох з них) та температури. Він є формальною ознакою, яка визначає ступінь залежності швидкості реакції від концентрацій учасників процесу.
. Порядок реакції може бути цілим, дробовим та нульовим. Частинні порядки іноді набувають навіть від’ємних значень. Порядок реакції не залежить від часу, концентрацій реагентів (якщо немає значного надлишку одного або декількох з них) та температури. Він є формальною ознакою, яка визначає ступінь залежності швидкості реакції від концентрацій учасників процесу.
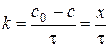 ; (1.4)
; (1.4)
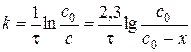 ; (1.5)
; (1.5)
 ; (1.6)
; (1.6)
 , (1.7)
, (1.7) - початкова концентрація вихідної речовини; х - зменшення концентрації вихідної речовини за час
- початкова концентрація вихідної речовини; х - зменшення концентрації вихідної речовини за час  ;
;  - поточна концентрація вихідної речовини, яка відповідає часу
- поточна концентрація вихідної речовини, яка відповідає часу 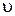 , експериментальні дані послідовно підставляють у рівняння (1.4) – (1.7). Співвідношення, що дає приблизно однакові константи швидкості, які відрізняються у межах похибки досліду, вказує на порядок реакції за певним компонентом.
, експериментальні дані послідовно підставляють у рівняння (1.4) – (1.7). Співвідношення, що дає приблизно однакові константи швидкості, які відрізняються у межах похибки досліду, вказує на порядок реакції за певним компонентом.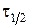 називається час, за який концентрація вихідної речовини зменшується удвічі.
називається час, за який концентрація вихідної речовини зменшується удвічі.
 , (1.8)
, (1.8) ,
,  ,
,  ,
,  - відповідно швидкості та константи швидкості за температур, які відрізняються на 10 К. У рівнянні (1.8) відношення швидкостей реакції дорівнює відношенню її констант швидкостей, оскільки концентрації реагентів в результаті збільшення температури на 10 градусів майже не змінюються. Зазвичай у температурні залежності швидкості реакції замість неї підставляють саме константу швидкості, оскільки вона, на відміну від швидкості, не залежить від часу та концентрацій.
- відповідно швидкості та константи швидкості за температур, які відрізняються на 10 К. У рівнянні (1.8) відношення швидкостей реакції дорівнює відношенню її констант швидкостей, оскільки концентрації реагентів в результаті збільшення температури на 10 градусів майже не змінюються. Зазвичай у температурні залежності швидкості реакції замість неї підставляють саме константу швидкості, оскільки вона, на відміну від швидкості, не залежить від часу та концентрацій. . (1.9)
. (1.9) , (1.10)
, (1.10) :
: . (1.11)
. (1.11) – енергія активації реакції, тобто та мінімальна енергія, яку потрібно надати 1 молю вихідних речовин, щоб вони мали змогу перетворитись у продукти.
– енергія активації реакції, тобто та мінімальна енергія, яку потрібно надати 1 молю вихідних речовин, щоб вони мали змогу перетворитись у продукти.  .
. можна записати також у вигляді:
можна записати також у вигляді: , (1.12)
, (1.12) – стала інтегрування. З виразу (1.12) випливає, що
– стала інтегрування. З виразу (1.12) випливає, що 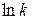 є лінійною функцією від
є лінійною функцією від  . Тангенс кута нахилу цієї прямої та енергія активації пов’язані залежністю
. Тангенс кута нахилу цієї прямої та енергія активації пов’язані залежністю . (1.13)
. (1.13)


