Состояние и перспективыС древних времен человечество использует растения для исцеления от различных болезней. Ранозаживляющий, вяжущий, противовоспалительный и др. полезные свойства растений, обладающих биологической активностью позволили использовать их для лечения многих заболеваний. Отвары, сиропы, экстракты, настои и микстуры, полученные из трав, цветков, корней и других частей лекарственных растений применяются в медицине и в настоящее время. Однако выделение технологии лекарств как отдельной области науки и появление других, более удобных для применения форм лекарственных средств в виде таблеток, порошков, пилюль, драже и др. вытеснили травы на второе место. В настоящее время медицина обладает широким ассортиментом лекарственных препаратов, полученных как из природного сырья, так и синтетическим путем. Лекарственные средства, различающиеся по составу и структуре, стали эффективно применяться для профилактики и лечения почти всех видов болезней. Количество новых лекарственных средств, появляющихся на фармацевтическом рынке увеличивается с каждым годом. Однако при этом нужно учитывать, что применение сильнодействующих лекарственных препаратов в течение длительного времени и в достаточно больших дозах влечет за собой проявления множества побочных (токсико-аллергических) реакций. Одной из попыток уменьшения побочных эффектов лекарственных препаратов стало создание комплексов «полимер-лекарство» или так называемых физиологически активных полимеров, приведенных в работах А.Н. Платэ в 70-х годах 20-века [1]. Первоначально синтетические и модифицированные природные полимеры использовались в качестве вспомогательных веществ для доставки лекарственных препаратов в организм [1, с.676-680; 2,3]. Основные задачи, решаемые с помощью полимерных вспомогательных веществ, связаны с постепенным поступлением лекарственных препаратов в организм, поддержанием их постоянной концентрации в крови, сокращением дозы принимаемых препаратов [4-7]. За последние годы возможности и эффективность лекарственной терапии значительно расширились, что обусловлено созданием и внедрением в медицинскую практику новых лекарственных форм. В этом случае в качестве носителей лекарственных веществ (ЛВ) выступают полимерные материалы, что позволяет придать лекарственной форме принципиально новые свойства. Исследования показали несомненную перспективность использования полимерных материалов для лечения таких хронических болезней, как туберкулез, рак, артериальная гипертония и др., требующих длительного и многократного приема больших доз лекарственных препаратов [8-13]. Значительные успехи в области эндопротезирования связаны с применением полимерных материалов на основе полиуретанов, обладающих высокой биосовместимостью и биодеградируемостью [2, c.112; 3, c.86]. Успешно
10
используются в некоторых областях медицины полимерные гидрогели - мягкие эластичные материалы, способные сорбировать значительное количество воды. К настоящему времени разработано и описано большое количество различны х полимерных материалов с лечебным действием, некоторые из них уже выпущены на рынок, многие находятся на стадии лабораторных и предварительных медико-биологических испытаний [2, c.121; 3, c.94-96; 8, c.374; 9, c.44]. Клиническое применение нашли различные имплантаты, суппозитории, накожные терапевтические системы, осмотические мининасосы, глазные и буккальные лекарственные пленки, лечебные контактные линзы, иммобилизованные тромболитические препараты, микрокапсулы, многослойные таблетки и др. [2, c.118; 3, c.99-103; 10, c.89-90]. До недавнего времени к вспомогательным веществам предъявляли требования только фармакологической и химической индифферентности [2, c.120; 3, c.101;]. Однако выяснилось, что эти вещества могут в значительной степени влиять на фармакологическую активность ЛВ. Влияя на фармакологическую активность лекарственного препарата (ЛП), вспомогательные вещества способны усиливать или ослаблять активность лекарственного средства, обеспечивать местное или общее воздействие на организм, изменять скорость наступления эффекта (ускорять или пролонгировать действие), обеспечивать направленный транспорт или регулируемое высвобождение ЛВ [4, c.145]. Эти вещества влияют не только на терапевтическую эффективность ЛВ, но и на стабильность лекарственны х форм (ЛФ) в процессе их изготовления и хранения, что имеет не только медицинское, но и экономическое значение, так как позволяет увеличить срок годности ЛП. Большие перспективы в лекарственной терапии связаны с направленным транспортом ЛВ в орган-мишень с использованием полимерны х микроносителей. Полимер-носитель определяет в основном физико-химические, и отчасти биологические свойства ФАП, а также объединяет элементы ФАП – действующее начало и группировки, обеспечивающие «узнавание» цели и проникновение в клетки, в единое целое [1, c.682; 8, c.375]. Для использования в качестве носителей ЛВ полимеры должны удовлетворять ряду требований: - полимер должен растворяться в воде. Растворимость создается определенным гидрофильно-липофильным балансом между присутствующими в полимере полярными группами и гидрофобными участками. - молекулярная масса и молекулярно-массовое распределение полимера- носителя должны обеспечивать достаточно длительную циркуляцию ФАП в кровяном русле. Для этого, а также при необходимости попадания ФАП внутр ь клетки посредством эндоцитоза полимер-носитель должен иметь достаточно высокую молекулярную массу. В то же время для выведения через почки молекулярная масса должна быть сравнительно низкой. Это противоречие может быть разрешено использованием биодеструктирующих полимеров [1, c.682; 8, c.376]. Оптимальная молекулярная масса полимеров-носителей в
11
большинстве случаев находится в пределах 20-80
тыс., для небиодеструктирующих полимеров ее приходится ограничивать до 30 тыс. - полимер-носитель должен содержать функциональные группы, к которым можно присоединить ЛВ. Как правило, это группы: - OH, -NH2, -CHO, -COOH. Реакции присоединения ЛВ должны быть по возможности просты и однозначны. - полимер-носитель должен быть биосовместимым, т.е. не взаимодействовать с кровью, не вызывать токсических эффектов и не быть антигенным. В последнее время увеличивается число исследований, в которы х в качестве носителя ЛВ используют физиологически активные полимеры: альбумин, гепарин, пирановый сополимер, поли-L-лизин и т.д. - полимер-носитель должен быть доступен, желательно, чтобы производство его для медицинских целей уже было освоено. Примером могут служить противошоковые кровезаменители и прежде всего декстран. В большинстве случаев экономически целесообразно специально производить полимеры для использования в лекарственных средствах, чтобы они отвечали всем необходимым требованиям по чистоте, безопасности, а также по молекулярной массе, молекулярно-массовым распределениям и другим характеристикам [1, c.678; 8, c.375; 14, c.141]. В разработку полимерных лекарственных систем большой вклад внесли немецкий ученый X. Рингедорф и чешский ученый И. Копеечек [1, c.678; 8, c.375; 14, c.141]. Преимуществом применения физиологически активных полимеров (ФАП), содержащих биологически активное вещество является пролонгированный эффект лекарства. Для реализации потенциальных возможностей ФАП, состоящих из действующего начала, присоединенного к полимерному носителю, все компоненты ФАП должны быть сконструированы и соединены между собой оптимальным образом. Так, была предложена следующая модель полимерного носителя, называемая моделью Рингсдорфа- Копечека [1, c.678; 8, c.375-376; 14, c.141] (рисунок 1).
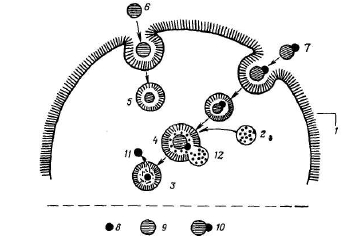
ЛВ
1 -полимер-носитель;
2 -ЛВ;
3 -лиганд («вектор»), обеспечивающий целенаправленный транспорт макромолекулы; 4 -гидрофильные группы, обеспечивающие растворимость макромолекулы в воде; 5 -«вставка» между полимером-носителем и ЛВ; Х-ковалентная связь между полимером-носителем и «вставкой»; Х'-ковалентная связь между «вставкой»
Рисунок 1 - Модель ФАП (по Рингсдорфу):
12
Суть модели заключается в том, что отдельные составные части ФАП объединяются в единое целое полимером-носителем. Полимер, главным образом, определяет физико-химические характеристики системы, а остальные части - фармакологические и фармакокинетические свойства [1, c.677-678; 8, c.375-376; 14, c.141]. Из рисунка видно, что к полимеру-носителю присоединено три вида групп: лекарственное вещество (ЛВ) вместе со связующим узлом («вставкой»); функциональные группы, обеспечивающие растворимость, чаще всего в воде; и группы («лиганды»), обеспечивающие узнавание клеток-мишеней, т.е. обеспечивающие целенаправленный транспорт [1, c.677-678; 8, c.375-376; 14, c.141]. Число и характер групп, обеспечивающих растворимость, должны быть таковы, чтобы лекарственный полимер полностью растворялся в воде. Гидрофильно-липофильный баланс, от которого зависят физико-химические свойства лекарственного полимера, регулируются этими группами. Наиболее часто используют связи –C=N -, - COO-, - C(=NH)NH-, -CONH- и т.п., причем гидролиз протекает главным образом ферментативно и глубина его сильно зависит от стерических и зарядовых эффектов. В связи с этим, целесообразно рассматривать связь лекарственного вещества с полимером не изолированно, а конструировать весь «связывающий» блок, который состоит из лекарственного вещества, «вставки» и двух химических связей по концам последней. Свойства этого блока в значительной мере определяет активность лекарственного полимера [1, c.677-678; 8, c.376; 14, c.141]. ФАП, к которым присоединены или в которые включены ЛВ, могут быть либо имплантированы в организм, где они постепенно распадаются, выделяя ЛВ или их растворимые полимерные производные, либо непосредственно введены в кровяное русло, где они циркулируют, выделяя ЛВ и постепенно поглощаясь клетками посредством эндоцитоза [1, c.679; 8, c.376-377]. Механизмы проникновения в клетку низкомолекулярных веществ и полимеров существенно различаются [1, c.679; 8, c.376-377]. В первом случае имеет место пассивная диффузия или активный транспорт, во втором наблюдается жидкофазный или адсорбтивный эндоцитоз (рисунок 2). Попавшие в клетки полимерные частицы перевариваются в лизосомах, если они способны к биодеструкции, и в результате выделяется включенное в них ЛВ [1, c.679-680; 8, c.376-377]. Посредством эндоцитоза ФАП в клетку удается ввести ЛВ, которые не способны проникать через клеточные мембраны. Особенно желателен эндоцитоз для транспорта ЛВ, действующих на лизосомы [14, c.141]. Конечным итогом жидкофазного эндоцитоза является слияние эндоцитотических вакуолей. Попав в лизосомы, ФАП расщепляется лизосомальными ферментами. Распаду подвергается не только связь ЛВ – полимер, но и сам полимер-носитель, если он способен к биодеструкции. Функция полимера в данном случае только транспортная. Во многих случаях в качестве полимеров-носителей в ФАП, для которых предусматривается рецептор-медиируемый эндоцитоз, используют белки [8, c.377; 14, c.141].
13
1-плазматическая мембрана; 2-лизосома; 3-пищеварительная вакуоль; 4- фагосома; 5-цитоплазматическая вакуоль; 6-эндоцитоз; 7-обманный эндоцитоз; 8-лекарство; 9-недиффундирующий носитель (полимер); 10-комплекс лекарство-носитель; 11-высвобождение лекарства; 12-слияние с лизосомой
Рисунок 2 - Схема клеточного эндоцитоза:
Следующим этапом создания лекарственных препаратов пролонгированного действия является связывание лекарств с водорастворимой полимерной подложкой химической связью. При этом возможно решение еще одной сложной задачи доставки лекарственного препарата непосредственно в орган-мишень. В этих целях в полимерной цепи предусматривается группировка атомов, являющихся своеобразным вектором, направляющим транспортную систему в «заболевший» орган. Эффективность в данном случае несомненна, но практическое применение ограничивается пероральным применением или нанесением транспортной системы на кожу или слизистую оболочку. Кроме того, остается неразрешенной проблема создания нацеливающего устройства, распознающего орган-мишень для доставки лекарственного препарата. В настоящее время в мировой практике наметились новые подходы к созданию лекарственных препаратов пролонгированного действия в виде конъюгатов полимер-лекарство нанометрических размеров [14, c.141; 15]. Принципиальным преимуществом таких форм транспортных систем является возможность инъекционной формы применения лекарственных препаратов. При этом появляется возможность включения в транспортную систему специфических агентов для целенаправленной доставки лекарства в клетки определенной локализации посредством эндоцитоза. Анализ литературы показал, что в качестве полимер-носителей могут быть использованы: декстран, целлюлоза, крахмал и их производные, полиэтиленоксиды, поливиниловый спирт, поливинилпирролидон, полиакриламид, полимолочная кислота, полимеры и сополимеры акриловой, метакриловой кислот и др. [2, c.21; 3, c.123-124; 10, c.93].
14
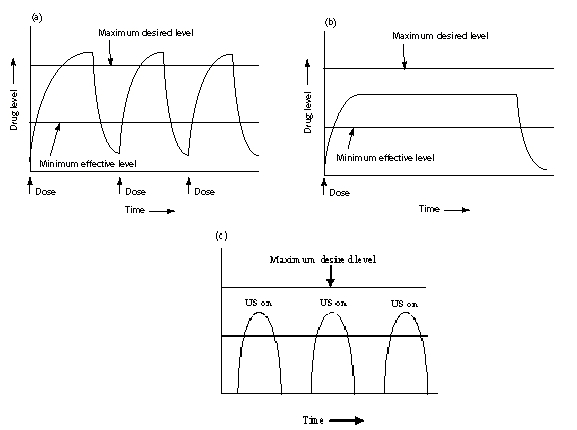
Использование инновационных форм лекарств на основе полимерных носителей в виде наночастиц (НЧ) и нанокапсул дает значительные преимущества по сравнению с использованием традиционных лекарственных форм (снижение нежелательных токсичных эффектов лекарства, пролонгирование действия лекарственного вещества, обеспечение целенаправленной доставки лекарства). На сегодняшний день известны два примера среди нанофармацевтических препаратов — полимер-протеиновый конъюгат Пегасис (Pegasys — пэгилированный альфа2а-интерферон) для лечения гепатита С и Нейласта (Neulasta — пегилированный hG-CSF) для терапии нейтропении. Главная и длительная цель фармацевтического производства – разработка терапевтических агентов, способных селективно доставляться в определенные области тела для повышения терапевтического показателя [16,17]. Лекарство, данное систематически, обеспечивает высокий эффект, но также может проявить обратные реакции. Исторически известным является существующий в химиотерапии рака пример достижения баланса между эффективностью и токсичностью лекарственного препарата [16, c.340; 17, c.15]. Цитостатики могут быть очень эффективны в разрушении опухолевых клеток, однако они могут оказывать такое же действие на нормальные клетки, приводя к обратным реакциям, а в некоторых случаях и эффектам, потенциально опасных для жизни. Концепция «Magic bullet», впервые предложенная Паулем Эрлихом в 1891 году, представляет собой первое описание парадигмы целенаправленной доставки лекарства [16, c.340; 18]. Целью направленной доставки лекарства является транспорт лекарственного препарата в место назначения в необходимой концентрации и для заданного промежутка времени. Одним из основателей в области создания наночастиц для контролируемого высвобождения лекарств был профессор технического университета Цюриха Питер Спайзер [18, c.2]. Наиболее важные его открытия – это идея не только осуществления целенаправленного транспорта лекарства наночастицами, а использование НЧ, которые, по его мнению, могли пройти через гемато- энцефалический барьер для доставки лекарств в мозг [18, c.3]. Несмотря на фантастичность идей, благодаря усилиям научной группы под руководством проф. П. Спайзера она воплотилась в реальность менее чем за 15 лет [18, c.3]. В последствии данное направление было развито последователем проф. П.Спайзера – проф. Й. Кройтером (Университет им. Гете, Франкфурт на Майне, Германия). Создание новых форм для уже существующих лекарств является многообещающим способом достижения этой цели, и это даст возможность поддержать эффективную концентрацию лекарства в крови в течение определенного промежутка времени, таким образом продлевая его терапевтический эффект. Примеры традиционного и пролонгированного дозирования, а также подача лекарства с применением УЗ показаны на рисунке 3.
15
Рисунок 3 - Уровень лекарства в крови при традиционном (a) и пролонгированном дозировании (b), контролируемой подачи лекарства по УЗ сигналу (с).
В настоящее время для этих целей создаются различные формы для лекарств, такие как коллоидные системы доставки лекарств (микро- и наночастицы, нанокапсулы, липосомы и т.д.) [15, c.2]. Преимуществом НЧ и нанокапсул над липосомами является их высокая стабильность в организме, а по сравнению с микрочастицами – их малый размер, который позволяет им проникать в более узкие кровяные капилляры [15, c.3]. Наносомальные формы лекарств разрабатываются на основе полимеров, которые уже имеют широкое применение в медицине. НЧ были впервые разработаны приблизительно 35 лет назад. Они первоначально были разработаны как носители для вакцин и препаратов в химиотерапии рака. НЧ - это стабильные, твердые коллоидные частицы, состоящие из биодеградируемого полимера и липидных материалов, размерами от 10 до 1000 нм [15, c.3; 18, c.4]. Лекарства могут быть адсорбированы на поверхности частицы, захвачены внутри полимера/липида или растворены внутри полимерных матриц [15, c.3]. Большинство фармацевтических исследований в направлении создания систем для доставки лекарственных препаратов на основе НЧ было сделано в области онкологии [16, c.342; 17, c.15]. Наноносители могут концентрироваться на месте локализации опухоли, в воспалительных тканях и в местах инфекций. Главное их различие от микросистем состоит в получении более тонких эмульсий и усложнении 16
процесса их стабилизации. Многочисленные публикации последних лет подтверждают перспективность применения лекарственных средств пролонгированного действия, созданных на основе полимерных микро- и НЧ и/или нанокапсул [10, c.89]. Увеличение времени действия таких препаратов достигается вследствие сохранения постоянной концентрации лекарства в организме в течение длительного времени, обеспечения направленного транспорта лекарственного вещества (ЛВ) в орган-мишень, повышения стабильности и биодоступности ЛВ, снижения скорости выведения действующего начала из организма. Пролонгирование действия лекарственного средства позволяет уменьшить лечебную дозу препарата в десятки и сотни раз, сохраняя при этом терапевтический эффект [15, c.2; 19]. Еще одним преимуществом использования пролонгированных лекарственных форм по сравнению с традиционными является возможность уменьшения и/или избежания токсико- аллергических реакций, которые достаточно часто возникают при повторном введении лекарственного препарата [15, c.2; 19, c.10]. Одним из разрабатываемых в последние годы вариантов пролонгированного действия и направленного транспорта ЛВ в орган-мишень является создание коллоидных систем, таких как липосомы, микрочастицы, микроэмульсии, НЧ и нанокапсулы [15, c.2]. НЧ отличаются от других видов носителей, прежде всего, большей стабильностью после введения их в организм [15, c.3]. НЧ получают путем полимеризации в эмульсии и их сшивании, генерации полимеров в дисперсной фазе сшиванием без химических реакций [15, c.4]. Механизм распределения лекарственного препарата, введенного в форме НЧ инъекционно, представляет довольно сложный процесс. Его особенностью является продолжительное присутствие препарата в плазме крови и дальнейшее накопление в различных тканях организма, как правило, в печени и селезенке [1, c.678; 6, c.1105; 10, c.90; 19, c.11]. Также необходимо отметить возможности усиления захвата липосом клетками организма. Так, покрытие поверхности наноносителей ферментами формирует вектор нацеливания для этих систем на органы-мишени и стимулирует захват или эндоцитоз НЧ [14, c.141]. Мелкодисперсные полиакриламидные НЧ и НК размером 20-80 нм, содержащие ЛВ, получают из полимеризованных мицелл заменой внешней фазы [14, c.141]. В соответствии с распределением физиологически активного вещества (ФАВ) и внутренней фазы НЧ представляют собой гомогенные образования, а НК состоят из внутренней фазы и оболочки. На современном этапе развития медицины приоритетными задачами являются поиск и разработка принципиально новых методологических подходов, а также усовершенствование традиционных способов терапии для повышения эффективности лечения злокачественных новообразований [9, c.44]. Достижения последних лет в области фармацевтической химии, молекулярной и клеточной биологии, молекулярной генетики и иммунологии определили основные направления исследований по созданию новых
противоопухолевых препаратов. Несмотря на создание новых противораковых препаратов, комбинации лекарств, различных по структуре и механизмам действия, используемые при интенсивной химиотерапии, оказывают значительное токсическое действие на организм в целом и приводят к развитию множественной лекарственной устойчивости. В связи с чем, проблема повышения эффективности действия противоопухолевых препаратов особенно актуальна в настоящее время. В последние десятилетия активно разрабатываются новые способы противоопухолевой терапии, которые бы обладали специфической направленностью, позволяя избирательно убивать клетки опухоли и пролонгировать действие лекарства [9, c.44]. Одной из перспективных разработок в этой области может быть система направленного транспорта. В качестве носителя, в комбинации с которым увеличивается продолжительность циркулирования противоопухолевого антибиотика в крови и за счет этого повышается эндоцитоз препарата опухолевыми клетками, могут быть использованы полимерные НЧ. Их применение для направленной доставки лекарств в опухолевые клетки позволило в ряде случаев достичь положительных результатов [2, c.125; 3, c. 156; 9, c.45-49]. Одной из главных проблем современной медицины является лечение такого заболевания, как туберкулез. В настоящее время проблема лечения туберкулеза приняла глобальный масштаб [20,21]. Поэтому проблема создания терапевтической системы, позволяющей осуществить направленный транспорт лекарства в место назначения в заданные сроки, особенно важна в химиотерапии туберкулеза, лечение которого требует многократного введения лекарства в организм в течение суток. Несмотря на широкий спектр существующих противотуберкулезных препаратов комбинации различных лекарственных средств (отличающихся по структуре и механизмам действия), используемых при интенсивном лечении, оказывают значительное токсическое действие на организм в целом и приводят к развитию множественной лекарственной устойчивости. Так как большинство противотуберкулезных препаратов имеют белковую структуру, их период полувыведения обычно очень короткий, т.е. они быстро выводятся из организма, следовательно, такие лекарства необходимо вводить парентерально не менее 2-х раз в день. Также, в связи с достаточно быстрым метаболизмом в организме большинства современных противотуберкулезных препаратов, только небольшая их часть оказывает полезное действие. Поэтому необходимы новые подходы для решения этой проблемы. Разработка новых форм для транспорта противотуберкулезных препаратов в виде полимерных НЧ и нанокапсул позволит обеспечить пролонгированное высвобождение лекарства поддержанием эффективной концентрации лекарственного вещества в крови в течение заданного промежутка времени, снизила бы побочные действия лекарственного препарата, таким образом повышая его терапевтический эффект.
Разработка наносомальных форм лекарственных препаратов, используемых в лечении туберкулеза и раковых заболеваний, позволяет обеспечить пролонгированное высвобождение лекарства в течение определенного промежутка времени, таким образом, снижая побочный эффект лекарственного вещества посредством уменьшения доз лекарства. Созданные в последние годы лекарственные антибактериальные средства направленного действия на основе полимерных носителей (с размерами 400 нм и менее) показывают характеристики, которые способны революционным образом изменить эффективность фармакологической коррекции различных патологических состояний [20, c.7; 21, c.4]. Установлено, что НЧ таких размеров проникают через гематоэнцефалический барьер, и тем самым способны оказывать терапевтические эффекты непосредственно на органы- мишени [15, c.4]. Исследование фармацевтических средств рациональной доставки и целенаправленного действия на различные клетки-мишени, мононуклеарные макрофаги, дендритные клетки, эндотелиоциты, клетки опухолей создают основу для разработки патогенетически обоснованной наномедицины XXI века [22]. Важнейшее достижение наномедицины в создании таких ЛФ заключается в получении ЛС пролонгированного действия с дозированным высвобождением активных субстанций, отличающихся высокой стабильностью и возможностью включения гидрофильных и гидрофобных субстанций. Главными преимуществами антибактериальных средств в биодеградируемых полимерах является резкое повышение биодоступности лекарств и уменьшение частоты приема необходимой дозы, способность непосредственного проникновения в очаг поражения, что является одной из важнейших проблем в лечении инфекционно-воспалительных и онкологических заболеваний, способность оказывать пролонгированное действие и тем самым существенно сократить кратность приема и значительно снизить риск развития нежелательных эффектов. Физиологические особенности систем жизнедеятельности макрофагов ретикулоэндотелиальной системы позволяет использовать макрофаги в качестве клеток-мишеней для целенаправленного действия нанопрепаратов, содержащих антибиотики в наносителях на макрофаги. Первым синтетическим полимером и биоабсорбирующим материалом была полигликолиевая кислота, которая открыла этот класс полимеров в 1954 г. C тех пор и по сегодняшний день техника доставки лекарственных средств использует полимеры - производные от молочной (полилактид) и гликолевой кислот, а также ε-капролактон [23-25]. Однако наилучшими показателями обладает сополимер полимолочной и полигликолевой кислот. В зависимости от процентного соотношения молочной и гликолевой кислот можно менять свойства продукта, например пластичность, прочность, срок биодеградации и др. Таким образом, из приведенных выше данных следует, что новый лекарственный препарат на основе антибактериальных субстанций различных классов потенциально должны содержать биодеградируемый полимер
(полимолочная и полигликолевая кислоты), поливиниловый спирт или ПАВ (полисорбат 80) и D-маннит [23, c.276-280; 24, c.124-128; 25, c.159-160]. Одним из наиболее перспективных способов введения лекарства в организм считается микро- и нанокапсулирование. Сущность микрокапсулирования состоит в заключении небольшого количества ЛВ в индивидуальные изолирующие оболочки различной природы. Для этих целей исследованы множества систем, в состав которых входили альгиновые кислоты, метил(этил)метакрилат, метакриловая кислота, поливинилпирролидон, 2,3- диоксиэтил(пропил)метакрилат, диметил(этил)аминоэтилметакрилат, трет- бутиламиноэтилметакрилат, карбопол, желатин и др. [1, c.676-682; 2, c.111-113; 3, c.95-96]. В настоящее время существуют различные методы получения полых структур для различных целей [26-46]. Микро- и нанокапсулы играют немаловажную роль и в фармацевтическом производстве. Капсулирование лекарств в полимерные нанокапсулы дает специальные возможности, такие как защита лекарства от разложения в биологической среде, скрытие неприятного вкуса лекарства, более того, возможно осуществление контролируемого высвобождения лекарственного вещества через полупроницаемую и/или стимул-чувствительную (термо- и/или рН-чувствительную) мембрану или обеспечение высвобождения биологически активного вещества созданием биодеградируемой оболочки. Способ микро- и нанокапсулирования выбирают в зависимости от целей, технологических возможностей, свойств капсулируемых веществ и полимерных материалов [26, c.413]. Процесс технологии микрокапсулирования заключается в измельчении ЛВ с последующим распределением в дисперсионной среде и покрытием его частиц полимерной пленкой. Вторая стадия может быть реализована физико-химическими, химическими и физическими методами, вплоть до чисто механических. В основе физико-химических методов лежит фазовое расслоение, и осаждение на границе раздела фаз. К химическим методам относится межфазная поликонденсация [26, c.413; 32, c.120; 38, c.3123]. Различные методы используются для получения нанокапсул, например, нанесение одного слоя на другой в случае липосом и везикул [26, c.413], метод «жертвенного» ядра, при котором ядро капсулы удаляют после образования плотной, стабильной оболочки [26, c.413], межфазная полимеризация или поликонденсация в миниэмульсиях [26, c.413; 31, c.310] и другие [26, c.413]. В процессе микрокапсулирования технологи сталкиваются с рядом трудностей: несплошное покрытие ЛВ оболочкой, неравномерность толщины оболочки, слишком низкая или наоборот, слишком высокая пористость покрытия, недостаточная стабильность препарата, неудовлетворительная воспроизводимость процесса и т.д. Установлено, что физико-химические показатели качества микрокапсул и кинетика высвобождения ЛВ из них определяются условиями перемешивания дисперсионной системы, массовым соотношением полимер:ядро, концентрацией раствора полимера и др. факторами. Так, при разработке технологии микрокапсулирования
ацетилсалициловой кислоты (АСК) с использованием ацетилфталил целлюлозы (АФЦ) показано, что увеличение скорости перемешивания приводит к уменьшению размера капсул [40]. Этими же авторами установлено, что соотношение АФЦ: масса АСК оказывает влияние на форму микрокапсул и равномерность покрытия ЛВ полимерной оболочкой [40, c.22]. Механическая прочность капсул и скорость высвобождения ЛВ из них находятся в зависимости от концентрации раствора полимера, причем наилучшие результаты получены при использовании раствора АФЦ с концентрацией 7,5% [40, c.23].. Авторы работы [41], исследуя процесс микрокапсулирования левомицетина в оболочке из АФЦ, получили данные, свидетельствующие об увеличении размеров микрокапсул при повышении концентрации раствора полимера вследствие возрастания вязкости системы. Оптимальной признана концентрация АФЦ 13,2%. В работе также показана зависимость физических характеристик микрокапсул от степени измельчения левомицетина [41, c.8]. При отработке технологии получения микрокапсул норсульфазола с использованием желатиновой оболочки [42] исследовалось влияние содержания капсулируемого вещества в дисперсной системе на показатели качества продукта. При добавлении в систему ЛВ увеличивались коэффициент использования полимера, плотность микрокапсул и насыпная масса, однако наблюдали уменьшение толщины оболочек и снижение сыпучести [42, c.34]. Интересные данные по изучению фармакокинетики микрокапсулированной формы масляного раствора дибунола, полученной методом простой коацервации, исследованию стабильности желатиновых микрокапсул в зависимости от технологических условий приведены в работе [43]. На основании литературных данных можно сделать вывод о наличии общих закономерностей в различных технологических подходах к решению проблемы микрокапсулирования, однако конкретные технологические параметры для каждой системы требуется подбирать индивидуально с учетом природы физиологически активных веществ и полимерной матрицы [41, c.5-7; 42, c.31-33; 43, c.23-27; 44, c.68-71]. Сравнительные анализы ЛФ, обычно используемых для перорального введения с микрокапсулированными препаратами, бесспорно, подтверждают преимущества последних [41, c.5-7; 42, c.31-33; 43, c.23-27; 44, c.68-71, 45]. В работе А.С. Николаева с соавторами [45] дана сравнительная оценка биологической доступности АСК из таблеток и капсул, содержащих микрокапсулы вещества, и из таблеток заводского производства в эксперименте на кроликах. По результатам исследования установлено, что при введении в кровь АСК с помощью таблеток заводского производства максимальная концентрация ЛВ в крови отмечается через 4 часа и составляет 178-194 мкг/мл, однако в последующие 4 ч содержа
|