Ышқылдық негіздікФорма форма Бұл екі форманың да тепе-теңдік ығысқанда түстері өзгереді. Бұл процесстің тепе-теңдігінің концентрациялық константасы төмендегідей болады:
IndА және IndB екі форманың бояулары әртүрлі, осы жағдайлардағы индикатор ерітіндісінің түсі келесі қатынастарға байланысты болады:
Қышқылдық-негіздік титрлеудегі қателердің көздері. Индикатор бір формадан екінші формаға өтуі үшін титранттың біршама бөлігі жұмсалады. Оны «индикаторлық қате» деп атайды. Титрлеудің сутектік қатесі сілтіні қышқылмен артық титрлеу және қышқылды сілтімен соңына дейін титрлемеу нәтижесінде Н3О+-иондарының артығынан болады. Титрлеудің гидроксилдік қатесі қышқылды сілтінімен артық титрлеу және сілті қышқылдымен соңына дейін титрлемеу нәтижесінде гидроксил-иондарының артығынан болады. Қышқылдық немесе негіздік қателер титрленген ерітіндіде аз джиссоциацияланатын қышқылдар мен негіздердің артығынан болады. Негізгі [1-3], Қосымша [4-11]. Мерзімдік әдебиеттер [12-14] Электрондық оқулықтар мен оқу құралдары [15-16] Интернет көздері [17-20] Дәріс тақырыбы: Тотығу-тотықсыздандыру титрлеу процессі, индикаторлар. Титрлеу қисығының түріне әсер көрсететін факторлар және әдісінің индикаторы. Дәріс тезистері:Тотығу- тотықсыздану титрлеу әдістері әрекеттесуші заттардың тотығу дәрежесінің өзгеруімен байланысты реакцияларға немесе тотығу- тотықсыздану реакцияларына редоксиметрия, оксидиметрияға негізделген. Редоксиметрияда стандартты ерітінді ретінде тиісті тотықтырғыш пен тотықсыздандырғыштардың ерітінділері қолданылады. Бұл жағдайда тотықтырғыш ерітінділермен титрлеу әдістерін - оксидиметриялық, ал тотықсыздандырғыш ерітінділермен титрлеу әдістерін - редоксиметриялық деп атау келісілген. Ең кең тараған тотықтырғыштар перманганат, хромат(бихромат), ванадат, бромат, иодат, иод, темір(III) және т.б. болып табылады. Тотықсыздандырғыштардан жиі иод, тиосульфат, иодид, сутек пероксиді, темір(II) және т.б. болып табылады. 100000-нан астам тотығу-тотықсыздану реакцияларының ішінен төмендегі талапқа жауап беретін реакциялар ғана қолданылады: олар соңына дейін тез және стехиометриялық түрде өтуі керек; химиялық құрамы формуласына сәйкес өнімдер түзілуі керек; титрлеудің соңғы нүктесін дәл белгілеуге мүмкіндік туғызатын болуы қажет; зерттелетін ерітіндідегі қосымша заттармен титранттар реакцияға түспеуі керек. Тотықтырғыш және тотықсыздандырғыштарды тіке және кері титрлеу арқылы, сондай-ақ ауыспалы валенттіктері болмайтын иондарды жанама анықтау үщін редоксиметрия әдісі қолданылады. Қосылған титранттың мөлшерінің функциясы ретінде индикаторлық электродтың потенциалын өлшейтін кез-келген титрлеу - потенцияметриялық титрлеу деп аталады. Кейбір титрантардың бояуы өте интенсивті болады, сондықтан олар титрлеудің соңғы нүктесінің индикаторлары бола алады. Мысалы, калий перманганатының өте аз мөлшерінің қатысында титрленетін ыдыста бояудың пайда болуы титрлеудің соңғы нүктесін көрсетеді. Бірақ жүйе ерітіндісінің құрамында басқа бояуы бар түсті заттар болса, онда титрлеудің соңғы нүктесін анықтау үшін бұл әдіс қолданылмайды. Иодтың суда нашар еруіне байланысты иодтың титрленген ерітінділерін металл иодтың дәл өлшендісін KІ-тың концентрлі ерітіндісінде ерітіп даярлайды. Ол І2-мен комплекс түзу арқасында тәжірибеде иодтың стандартты потенциалын өзгерпей-ақ епу жылдамдығын және иодтың ергіштігін елеулі арттырады. Индикатор ретінде ерітіндінің бояуын өзгертетін тотықтырғыш және тотықсыздандырғышпен реакцияға түсетін заттардың ерітіндісін пайдаланады. Оксидиметриялық әдістерде жүйенің тотығу-тотықсыздану потенциалының шамасына байланысты өхдерінің бояуын өзгертетін индикаторлар қолданылады. Негізгі [1-3], Қосымша [4-11]. Мерзімдік әдебиеттер [12-14] Электрондық оқулықтар мен оқу құралдары [15-16] Интернет көздері [17-20] Дәріс тақырыбы: Перманганатометрия. Бірінші стандарттар. Иодометрия. Бихроматометрия. Іс жүзінде бұл әдістердің қолданылуы. Тұнбалау әдісі. Аргентометрия. Мор, Фаянс және Фольгард әдістері. Дәріс тезистері: Тотығу-тотықсыздану реакцияларының титрлеу қисықтарын тотығу-тотықсыздану потенциалы - қосылған жұмысшы ерітіндінің көлемі координаттарында құрады. Тотығу-тотықсыздану титрлеу қисығының секіріс шамасына бірнеше фактор әсер етеді: 1. Титрленетін зат пен титранттың табиғаты. Неғұрлым титрленетін зат пен титранттың стандартты потенциалдар айырымы үлкен болса, соғұрлым титрлеу қисығында секіріс үлкен болады. 2. рН-шамасы. Егер тотығу-тотықсыздану жартылай реакцияларына сутек иондары қатысса, олардың концентрацияларының мәні тікелей Нернст теңдеуіне кіреді, демек, титрлеу қисығының секіріс шамасына әсер етеді. Бұл жағдайда стандартты потенциалдардың орнына формалды потенциалдар қолданылады. 3. Тотықтырғыш немесе тотықсыздандырғыштың қатысымен жарыспалы комплекс түзілу реакцияларының жүруі. Мұндай жағдайда титрлеу қисығын есептеу кезінде стандартты емес, формалды потенциалдарды қолдану керек. Тұндыру әдісімен титрлеу нашар еритін қосылыстар түзілетін реакцияға негізделген. Бұл реакциялар бөлме температурасында жеткілікті тез және іс жүзінде қайтымсыз өтеді. Тұндыру реакциясының көптігіне қарамастан, тұндырып титрлеу кең таралмады. Тұндыру әдісімен титрлеу әдістерінің ең кең тарлған аргентометрия және меркуриметрия, сондай-ақ роданидометрия және цианометрияны атап көрсете аламыз. Тұндырып титрлеудің басқа әдістері сирегірек қолданады, себебі олар үшін эквивалент нүктесін белгілеп алатын сенімді индикаторлар табылған жоқ. Аргентометрия. Бұл әдісте негізінен галогенидтерді анықтау үшін күміс нитратының ерітіндісін қолданады. Әдістің әр түрі бар: Мор әдісі бойынша хлорид- және бромид-иондарын, олардың тұздарын анықтау; Фаянс әдісі бойынша бромидтер, иодидтер және роданидтерді адсорбциялық флуоресциин индикаторымен анықтау; Фольгард әдісі бойынша бромидтер, иодидтерді (кері титрлеу) анықтау. Аргентометриядағы негізгі жұмысшы ерітінділер күміс нитраты натрий хлориді және аммоний немесе калий тиоцинатының ерітінділері болып табылады. AgNO3 ерітіндісін күңгірт шыны ыдыстарға сақтайды, себебі жарықта күміс тұздары металл күмісті майда дисперсті күйде бөліп шығарып, ыдырайды. AgNO3 eрітіндісінің дәл титрін хлорлы натрий стандартты ерітіндісі бойынша анықтайды. NaCl (немесе КСl), NH4SCN (немесе KSCN) ерітінділерін қайта кристалданған тұздардан даярлайды. Тиоцианаттардың дәл концентрациясын күміс нитратының титрленген ерітіндісі бойынша табады. Мор әдісі. Бұл әдіс Ag+ және Cl— -тің арасында өтеді және хромат-ион индикатор болып табылады. Сонымен қатар ол Ag2CrO4 қызыл-кірпіш түсті тұнба түзеді. Күміс галогенидтеріне қарағанда (S(Ag2CrO4)= CrO42-+H+ → HCrO4- және 2HCrO4 →Cr2O72- +2H2O рН < 6,5 болғанда индикатор сезгіштігі төмендейді, ал рН > 10,5 болса тұнбаға түседі. Ал сілтілік ортада мынадай реакцияның өтуін байқау керек: Ag++OH- = AgOH↓, 2AgOH = Ag2O+H2O Мор әдісі иодид және тиоцианат иондарын анықтауда пайдаланылмайды. Фольгард әдісі. Осы әдіс Ag+ ионын роданид (KSCN) ерітіндісімен Fe(n) –тің қатынасында титрлеуге негізделген: Ag++SCN-=AgSCN↓ Fe3++nSCN-=Fe(SCN)n(3-n)+ Индикатор – темір (3) тиоционат комплексі. Ag+ иондарын титрлегеннен кейін титранттың артық мөлшері Fe3+ ионымен қызыл комплекс береді. Титрлеу қышқылдық ортада жүргізіледі. Пайдаланатын темір реакциясы 10-3 М тиоцианатты анықтауға мүмкіндік береді. Эквиваленттік нүктеде иондар концентрациясы тең болады. [Ag+] = [SCN-] = Тиоцианаттың мұндай концентрацияда темірдің тиоцианаттық комплексінің бояуын анықтау мүмкін емес. Калий тиоцианатының артық тамшысынан анық қызғылт- сары бояу пайда болады. Фольгард әдісі күміс ионымен нашар еритін қосылыстар түзетін мысалы: оксалаттар, фосфаттар және басқалар сияқты аниондарды титрлеуге мүмкіндік туғызады. Титрлеуді қышқылдық ортада өткізеді, бұл - әдістің елеулі құндылығы болып табылады. Фаянс әдісі. Берілген әдісте адсорбциялық индикатор – қосылыстар қолданылады. Олар тұнбаға адсорбцияланғанда өзінің түсін өзгертеді. Ең бірінші түзілген тұнба бетіне онымен бір аттас иондар адсорбцияланады. Бромидті күміс нитратымен титрлегенде AgBr тұнбасының бетіне бромид-иондары эквиваленттік нүктесіне дейін көбірек адсорбцияланады. Ал артық теріс зарядты бейтараптау үшін тұнба бөлшектеріне ерітіндіден оң зарядталған иондар тартылады. Эквиваленттік нүктесінен кейін Ag+ иондарының артықтары тұнба бетіне адсорбцияланады және енді зарядталған тұнбаны бейтараптау үшін ерітіндіден теріс зарядталған иондар қажет.Мысалы, индикатор аниондары. Кейбір бояғыштардың аниондары адсорбцияланып, түсін өзгертеді. Адсорбциялық индикатордың әсер ету механизмі осыған негізделген. Хлоридті титрлеу үшін жиі қолданылатын адсорбциялық индикатор флуоресценн болып табылады. Ол ерітіндідегі жасыл-сары бояуын AgHal күйіндегі тұнба бетінде адсорбцияланған қызыл түске өзгертеді. Бұл индикатормен титрлеуді рН = 7-10 болғанда жүргізеді. Себебі ол әлсіз қышқыл болып табылады. (рК = 8) Негізгі [1-3], Қосымша [4-11]. Мерзімдік әдебиеттер [12-14] Электрондық оқулықтар мен оқу құралдары [15-16] Интернет көздері [17-20]
|

 ;
; ,
, 
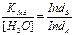
 = 6,5*10-5M; SAgCl = 1,3*10-5M, S(AgB4 ) = 7,2*10-7M ерігіштігі жоғары. Титрлегенде галогенид-ион титрленбейінше күміс хроматы түзілмейді. Ол үшін хромат-ионның концентрациясын дұрыстап алу қажет. Егерде концентрация өте аз болатын болса, онда тұнба алу үшін күмістің артық мөлшері қажет болады. Егер концентрация артық мөлшерде алынса, галогенид-ион титрленгенше, тұнба ерте түседі. +0,1 % қателікте CrO4 – тің концентрациясын 0,35М-дан 1,1*10-4 М-ға дейін өзгертуге болады. Хроматпен титрлеу бейтарап немесе әлсіз сілтілік ортада, ерітіндінің рН-ы 6,5-10,5 аралығында болғанда жүргізіледі. Сілтілік ортада гидро-хромат-ионмен тепе-теңдікте болатын хромат-иондары басымырақ, алдыңғысының түзілуі қышқылдау аймақта мына теңдеуге сәйкес басталады:
= 6,5*10-5M; SAgCl = 1,3*10-5M, S(AgB4 ) = 7,2*10-7M ерігіштігі жоғары. Титрлегенде галогенид-ион титрленбейінше күміс хроматы түзілмейді. Ол үшін хромат-ионның концентрациясын дұрыстап алу қажет. Егерде концентрация өте аз болатын болса, онда тұнба алу үшін күмістің артық мөлшері қажет болады. Егер концентрация артық мөлшерде алынса, галогенид-ион титрленгенше, тұнба ерте түседі. +0,1 % қателікте CrO4 – тің концентрациясын 0,35М-дан 1,1*10-4 М-ға дейін өзгертуге болады. Хроматпен титрлеу бейтарап немесе әлсіз сілтілік ортада, ерітіндінің рН-ы 6,5-10,5 аралығында болғанда жүргізіледі. Сілтілік ортада гидро-хромат-ионмен тепе-теңдікте болатын хромат-иондары басымырақ, алдыңғысының түзілуі қышқылдау аймақта мына теңдеуге сәйкес басталады: =
=  -2 =1,05*10-6 M
-2 =1,05*10-6 M


