Реактиви. 1. Стандартні 0,01 М розчини амінокислот (кількість кожної амінокислоти, що відповідає 0,01 М розчину1. Стандартні 0,01 М розчини амінокислот (кількість кожної амінокислоти, що відповідає 0,01 М розчину, зважують на аналітичних терезах і розчиняють в 0,01 н розчині соляної кислоти). 2. 0,5% -й розчин нінгідрину в ацетоні (95 частин 0,5%-го розчину нінгідрину в ацетоні, 1 частина льодяної оцтової кислоти і 4 частини води змішують безпосередньо перед визначенням). 3. 0,005%-й розчин CuSO4×5H2O в 75%-му етиловому спирті (5 мг сульфату міді розчиняють в 22 мл води і об¢єм доводять 96%-м спиртом до 100 мл). 4. 96%-й етиловий спирт.
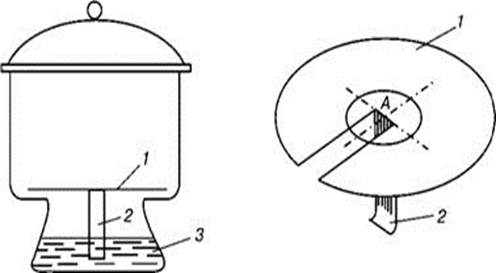
Матеріали та обладнання Листок хроматографічного паперу (10 х 10 см), дозатори з наконечниками, кювета з розчином нінгидрину в ацетоні, пробірки скляні зі штативом, витяжна шафа, термостат з t = 600 С, термостат з кімнатною температурою, ФЕК з довжиною хвилі 540 нм (зелений світлофільтр), кювети 5 мм, лінійка, олівець, ножиці. Загальні відомості Для хроматографічного розподілу амінокислот в суміші та їх кількісного визначення застосовується метод розподільної хроматографії на папері, запропонований у 1944 р. Мартіном і Сінджем, який базується на розподілі речовин рухомої фази відносно нерухомого носія в залежності від їх спорідненості з носієм. Амінокислоти можуть бути розподілені між двома рідкими фазами, що не змішуються, в таких системах як фенол-вода або н -бутанол-вода. Розчинені амінокислоти розподіляються між рівними об¢ємами двох рідин. Відношення концентрацій амінокислоти у рідких фазах, що знаходяться у стані рівноваги при даній температурі називається коефіцієнтом розподілу. Кожна амінокислота має характерний тільки для неї коефіцієнт розподілу, що відповідає даній парі розчинників. Якщо одна речовина з низьким коефіцієнтом розподілу Z рухається по хроматографічному папері швидше ніж речовина Y, що має більш високий коефіцієнт розподілу, то через деякий час ці речовини повністю розділяться. При цьому спостерігається концентрація кожної речовини в певному місці у вигляді плями. За напрямком руху елюента паперову хроматографію так як і тонкошарову за рухомою фазою розділяють на висхідну, низхідну і радіальну (кругову) паперову хроматографію: - якщо елюент рухається по паперу знизу вверх, хроматографія називається висхідною (а) паперовою хроматографією; - якщо зверху вниз - низхідною (б) паперовою хроматографією; - у методі радіальної паперової хроматографії (в) використовується паперове коло (г) з гнотом, опущеним у елюент (рис. 2.1 та 2.2).
Рис.2.1. Радіальна хроматографія: А - місце нанесення зразка, 1- хроматографічний папір, 2 - фітіль для подачі розчинника; 3 - розчинник
Рис. 2.2. Розділення пігментів чорнил методом радіальної тонкошарової хроматографії Іноді складну багатокомпонентну суміш не вдається розділити на компоненти за допомогою одного розчинника. Тоді застосовують двовимірну хроматографію. Хроматографічне розділення такої суміші проводиться послідовно в двох напрямках на квадратному листку хроматографувального паперу з використанням двох різних систем розчинників. В такому випадку одержуємо двовимірну карту розташування різних амінокислот. У кут квадратного аркуша хроматографічного паперу наносять розчин проби і хроматографують спочатку в одному напрямку з певним елюентом, а потім, повертають хроматографічний папір на 90о і хроматографують в іншому напрямку з іншим елюентом (рис 2.3.).
Рис. 2.3. Розподіл суміші 22 вільних амінокислот методом двовимірної хроматографії на папері
Перший елюент проводить попереднє розділення компонентів проби, другий остаточне розділення суміші на компоненти. Місцеположення кожного з компонентів суміші визначають хімічними або фізико-хімічними методами. В якості носія нерухомої фази використовується чиста целюлоза у вигляді спеціального фільтрувального паперу, який повинен бути особливо чистим та мати дуже рівномірно розподілену щільність. Целюлоза, з якої складаються волокна фільтрувального паперу, що застосовується в хроматографії, знаходяться в гідратованому стані. В міру того як розчинник, що містить суміш амінокислот, рухається під дією капілярних сил по листку паперу, проходить безліч мікроскопічних актів розприділення амінокислот між рухомою фазою та стаціонарною фазою, пов¢язаною з волокнами бумаги. В кінці цього процесу різні амінокислоти проявляються на різній відстані від старту. Існує кілька різновидів хроматографічного паперу, який відрізняється товщиною та щільністю: - папір № 1 та 2 менш щільний і називається "швидким"; - папір № 3 і 4 — "повільним". Звичайні сорти паперу гідрофільні і містять до 20-22 % вологи. Тому при використанні води як нерухомої фази спеціального зволоження для хроматографічного паперу не потрібно. Метод кількісного визначення амінокислот в розподільній хроматографії на папері застосовуєтся для після їх хроматографічного розділення. В основі методу лежить реакція амінокислоти з нінгідрином. Усі вільні a - амінокислоти дають з нінгідрином синьо-фіолетове забарвлення. Реакція характерна для аміногруп, які знаходяться в a - положенні і використовується для виявлення a - амінокислот. Реакція проходить у слабокислому середовищі з подальшим перетворенням отриманого в результаті реакції нестійкого похідного міді синьо-фіолетового кольору — дикетогідринделідендикетогідрин-диамін (ДІДА) в стабільне похідне міді оранжево-червоного кольору, яке має максимум поглинання при 530 нм. Кількісне визначення амінокислот базується на вимірюванні оптичної густини Cu-похідного ДІДА після його екстракції з паперу. Лінійна залежність між вмістом амінокислот у плямі та оптичною густиною забарвлення знаходиться між 0,025 та 0,25 мкмоль амінокислоти. Метод застосовується для визначення всіх амінокислот, за винятком проліну і оксипроліну, які інакше реагують з нінгідрином і утворюють похідне міді іншої будови. Хід роботи Студенти розділяють на бригади по 4 особи, проводять попереднє тренування в нанесенні води на звичайний папір за допомогою шприца. Кожна бригада одержує: - листок хроматографічного паперу; - 2 пробірки з розчином амінокислоти відомої концентрації (1-ша пробірка) та розчином амінокислоти невідомої концентрації (2-га пробірка); - 5 пробірок з 5 мл 0,005%-го розчину сульфату міді в 75%-му етиловому спирті; - шприци, ножиці. На листку хроматографічного паперу олівцем відмічають лінію старту та 4 точки для нанесення розчинів амінокислот. На 1, 2, 3 точки наносять розчини амінокислоти відомої концентрації на 4-ту точку наносять розчин амінокислоти невідомої концентрації (рис. 2.4.). Шприцем наносять на 1-шу точку 1 краплину (5 мкл) розчину, на 2-гу точку 2 краплини (10 мкл), на 3-тю – 4 краплини (20 мкл) 0,01 М розчину амінокислоти або 0,05; 0,1; 0,2 мкмоль амінокислоти. На 4-ту точку наносять 2 або 3 краплини амінокислоти невідомої концентрації.
Рис. 2.4. Нанесення точок на хроматографічний папір
Розчини на кожну точку наносять після повного висушування попе-редньо нанесеного об'єму амінокислоти. Після нанесення амінокислоти на всі точки хроматографічний папір висушують на повітрі, а потім занурюють на кілька секунд у кювету з 0,5 %-м р-ном нінгідрину в ацетоні, просушують у витяжній шафі при кімнатній температурі і 15 хв прогрівають у термостаті при 60°С для проявлення забарвлення. Зони хроматограми з яскраво-ліловими плямами амінокислот вирізають. Збоку хроматографічного листка паперу на чистому місці вирізають кружок паперу (контрольна зона для порівняння), що дорівнює за площею дослідним. Вирізані зони паперу (зони 4-рьох точок та контрольна зона вирізана на чистому полі), подрібнюють ножицями і вміщують в 5 окремих пробірок, які підписують згідно з номером точки та контрольної зони. В кожну пробірку додають 5 мл 0,005%-го розчину сульфату міді в 75%-му етиловому спирті. Лілове забарвлення амінокислот переходить в оранжево-червоне внаслідок утворення Cu-похідного ДІДА і відбувається екстракція комплексної сполуки амінок-ти з паперу в розчин. Для повної екстракції пробірки на 30 хвилин ставлять у темне місце при кімнатній температурі. Потім проби фотометрують проти контролю (пробірка з розчином контрольної зони) на ФЕК при довжині хвилі 540 нм (зелений світлофільтр), кювета 5 мм. На основі знайденої оптичної густини для точок 1, 2, 3 та концентрацій амінокислоти, що відповідають цій оптичній густині будують в зошиті калібрувальний графік, де на осі абсцис відкладають концентрацію амінокислоти в мкмоль/мл, а на осі ординат – оптичну густину (показання ФЕК (рис. 2.5.). За знайденою оптичною густиною амінокислоти невідомої концентрації (пробірка 4) визначають її концентрацію по калібрувальному графіку.
Рис.2.5. Калібрувальний графік для визначення концентрації розчину амінокислоти
Завдання для виконання 1. Підготувати листок хроматографічного паперу для хроматографії (відмітити лінію старту та точки 1, 2, 3, 4). 2. Нанести 1, 2 та 4 об¢єми 0,01 М розчину амінокислоти на точки 1, 2, 3 (відповідно), причому кожну наступну порцію розчину наносять після повного висушування попередньої краплини. Занурити хроматограму на кілька секунд у кювету з 0,5%-м розчином нінгідрину в ацетоні. 3. Просушити хроматограму при кімнатній температурі та прогріти протягом 15 хв. для проявлення забарвлення в сушильній шафі при 600 С. 5. Зони хроматограми з яскраво-ліловими плямами амінокислот вирізати, подрібнити та помістити в окремі пробірки №1, №2, №3 та №4. 6. Збоку на чистому місці вирізати рівний за розміром кружок з бумаги, що буде слугувати контролем, також подрібнити та вмістити в пробірку №5. 7. Елюювати комплексну сполуку амінокислоти з паперу в розчин. 8. Витримати пробірки протягом 30 хв. в темному місці при кімнатній температурі. 9. Фотометрувати проти контрольної проби на ФЕК при 540 нм (зелений), кювета 5 мм. 10. На основі знайденої оптичної густини взятих концентрації побудувати калібрувальний графік, для чого на осі абсцис відкласти концентрацію амінокислот в мкмоль/мл, а на осі ординат – оптичну густину. 11. Знайти оптичну густину амінокислоти невідомої концентрації (пробірка №4) та за калібрувальним графіком визначити її концентрацію. 12.Написати висновок. Контрольні запитання 1. Розподільна хроматографія на папері. 2. Види розподільної хроматографії на папері. 2. Нерухома фаза в розподільній хроматографії на папері. 3. Види хроматографічного паперу. 4. Яка реакція лежить в основі методу. 5. Суть методу кількісного визначення амінокислот. 6. В чому необхідність контрольного розчину. 7. Для яких амінокислот застосовується даний метод і чому. РЕКОМЕНДОВАНА ЛІТЕРАТУРА 1. Лисенко, О.М. Вступ до хроматографічного аналізу. Навчальний посібник / О.М. Лисенко, Б.Й. Набиванець.- К.: Корвін Пресс, 2005. - 187 с. 2. Бёккер, Ю. Хроматография. Инструментальная аналитика: Методы хроматографии и капиллярного электрофореза / Ю.Бёккер. - М.: Техносфера, 2009.- 470 с.
|