Примеры решения задач. Пример 2.1.Рассчитать эквивалент и молярную массу эквивалентов H2S и NaOH в реакциях:Пример 2.1. Рассчитать эквивалент и молярную массу эквивалентов H2S и NaOH в реакциях: H2S + 2NaOH = Na2S + 2H2O; (1) H2S + NaOH = NaHS + H2O. (2) Решение. Молярная масса эквивалентов кислоты или основания, участвующихв кислотно-основной реакции, рассчитывается по формуле М эк (кислоты, основания) = где М – молярная масса кислоты или основания; n – для кислот – число атомов водорода, замещенных в данной реакции на металл; для оснований – число гидроксильных групп, замещенных в данной реакции на кислотный остаток. Значение эквивалента и молярной массы эквивалентов вещества зависит от реакции, в которой это вещество участвует. В реакции H2S + 2NaOH = Na2S + 2H2O (1) оба иона водорода молекулы H2S замещаются на металл и, таким образом, одному иону водорода эквивалентна условная частица ½ H2S. В этом случае Э (H2S) = ½ H2S, а М эк (H2S)= В реакции H2S + NaOH = NaHS + H2O (2) в молекуле H2S на металл замещается только один ион водорода и, следовательно, одному иону Э (H2S) = H2S, а М эк (H2S) = Эквивалент NaOH в реакциях (1) и (2) равен NaOH, так как в обоих случаях на кислотный остаток замещается одна гидроксильная группа. Молярная масса эквивалентов NaOH равна М эк (NaOH) = 40 г/моль. Таким образом, эквивалент H2S в реакции (1) равен ½ H2S, в реакции (2) − 1 H2S, молярные массы эквивалентов H2S равны соответственно 17 (1) и 34 (2) г/моль; эквивалент NaOH в реакциях (1) и (2) равен NaOH, молярная масса эквивалентов основания составляет 40 г/моль. Пример 2.2. Рассчитать эквивалент и молярную массу эквивалентов оксидов P2O5 и CaO в реакции P2O5 + 3CaO = Ca3(PO4)2. Решение. Молярная масса эквивалентов оксида рассчитывается по формуле М эк (оксида) = где М – молярная масса оксида; n – число катионов соответствующего оксиду основания или число анионов соответствующей оксиду кислоты; |c.o.| – абсолютное значение степени окисления катиона или аниона. В реакции P2O5 + 3CaO = Ca3(PO4)2 эквивалент P2O5, образующего два трехзарядных аниона (РО4)3-, равен 1/6 P2O5, а М эк (P2O5) = Пример 2.3. Вычислить эквивалент и молярную массу эквивалентов фосфора в соединениях РН3, Р2О3 и Р2О5. Решение. Чтобы определить молярную массу эквивалентов элемента в соединении, можно воспользоваться следующей формулой: М эк (элемента) = где МА – молярная масса элемента; |c.o.| – абсолютное значение степени окисления элемента. Степень окисления фосфора в РН3, Р2О3, Р2О5 соответственно равна –3, +3 и +5. Подставляя эти значения в формулу, находим, что молярная масса эквивалентов фосфора в соединениях РН3 и Р2О3 равна 31/3 = 10,3 г/моль; в Р2О5 – 31/5 = 6,2 г/моль, а эквивалент фосфора в соединениях РН3 и Р2О3 равен 1/3 Р, в соединении Р2О5 – 1/5 Р. Пример 2.4. Рассчитать молярную массу эквивалентов соединений фосфора РН3, Р2О3 и Р2О5. Решение. Молярная масса эквивалентов химического соединения равна сумме молярных масс эквивалентов составляющих его частей: М эк (РН3) = М эк (Р) + М эк (Н) = 10,3 + 1 = 11 г/моль; М эк (Р2О3) = М эк (Р) + М эк (О) = 10,3 + 8 = 18,3 г/моль; М эк (Р2О5) = М эк (Р) + М эк (О) = 6,2 + 8 = 14,2 г/моль. Пример 2.5. На восстановление 7,09 г оксида металла со степенью окисления +2 требуется 2,24 л водорода при нормальных условиях. Вычислить молярные массы эквивалентов оксида и металла. Чему равна молярная масса металла? Решение. Задача решается по закону эквивалентов. Так как одно из реагирующих веществ находится в газообразном состоянии, то удобно воспользоваться следующей формулой:
где V эк (газа) – объем одного моля эквивалентов газа. Для вычисления объема моля эквивалентов газа необходимо знать число молей эквивалентов (υ;) в одном моле газа: υ = Подставив в формулу Молярная масса эквивалентов химического соединения равна сумме молярных масс эквивалентов составляющих его частей. Оксид – это соединение металла с кислородом, поэтому молярная масса эквивалентов оксида представляет собой сумму М эк (оксида) = М эк (металла) + М эк (кислорода). Отсюда М эк (металла) = М эк (оксида) − М эк (кислорода) = 35,45 – 8 = 27,45 г/моль. Молярная масса эквивалентов элемента (М эк) связана с атомной массой элемента (М А) соотношением: М эк (элемента) = Таким образом, М эк (оксида) = 35,45 г/моль; М эк (металла) = 27,45 г/моль; М А (металла) = 54,9 г/моль. Пример 2.6. При взаимодействии кислорода с азотом получено 4 моль эквивалентов оксида азота (IV). Рассчитать объемы газов, вступивших в реакцию при нормальных условиях. Решение. По закону эквивалентов число молей эквивалентов веществ, вступающих в реакцию и образующихся в результате реакции, равны между собой, т.е. υ; (О2) = υ; (N2) = υ; (NO2). Так как получено 4 моль эквивалентов оксида азота (IV), то, следовательно, в реакцию вступило 4 моль эквивалентов О2 и 4 моль эквивалентов N2. Азот изменяет степень окисления от 0 (в N2) до +4 (в NО2), и так как в его молекуле 2 атома, то вместе они отдают 8 электронов, поэтому М эк (N2) = 3,5 г/моль N2 – х х = Так как в реакцию вступило 4 моль эквивалентов N2, то их объем составляет V (N2) = 2,8·4 = 11,2 л. Зная, что моль эквивалентов кислорода при нормальных условиях занимает объем 5,6 л, рассчитываем объем 4 моль эквивалентов О2, вступивших в реакцию: V (O2) = 5,6∙4 = 22,4 л. Итак, в реакцию вступило 11,2 л азота и 22,4 л кислорода. Пример 2.7. Определить молярную массу эквивалентов металла, если из 48,15 г его оксида получено 88,65 г его нитрата. Решение. Учитывая, что М эк (оксида) = М эк (металла) + М эк (кислорода), а М эк (соли) = М эк (металла) + М эк (кислотного остатка), подставляем соответствующие данные в закон эквивалентов:
отсюда М эк (металла) = 56,2 г/моль. Пример 2.8. Вычислить степень окисления хрома в оксиде, содержащем 68,42 % (масс.) этого металла. Решение. Приняв массу оксида за 100 %, находим массовую долю кислорода в оксиде: 100 – 68,42 = 31,58 %, т.е. на 68,42 частей массы хрома приходится 31,58 частей массы кислорода, или на 68,42 г хрома приходится 31,58 г кислорода. Зная, что молярная масса эквивалентов кислорода равна 8 г/моль, определим молярную массу эквивалентов хрома в оксиде по закону эквивалентов:
Степень окисления хрома находим из соотношения отсюда | c. o. | =
|

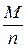 ,
,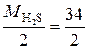 = 17 г/моль.
= 17 г/моль.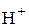 эквивалентна реальная частица – молекула H2S. В этом случае
эквивалентна реальная частица – молекула H2S. В этом случае =
=  34 г/моль.
34 г/моль.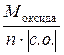 ,
,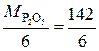 = 23,7 г/моль. Эквивалент СаО, дающего один двухзарядный катион (Са2+), равен ½ СаО, а М эк (СаО)=
= 23,7 г/моль. Эквивалент СаО, дающего один двухзарядный катион (Са2+), равен ½ СаО, а М эк (СаО)=  =
= 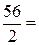 28 г/моль.
28 г/моль. ,
,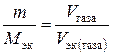 ,
,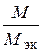 . Так, М (Н2) = 2 г/моль; М эк (Н2) = 1 г/моль. Следовательно, в одном моле молекул водорода Н2 содержится υ = 2/1 = 2 моль эквивалентов водорода. Как известно, моль любого газа при нормальных условиях (н.у.) (Т = 273 К, Р = 101,325 кПа) занимает объем 22,4 л. Значит, моль водорода займет объем 22,4 л, а так как в одном моле водорода содержится 2 моль эквивалентов водорода, то объем одного моля эквивалентов водорода равен V эк (Н2) = 22,4/2 = 11,2 л. Аналогично М (О2) = 32 г/моль, М эк (О2) = 8 г/моль. В одном моле молекул кислорода О2 содержится υ = 32/8 = 4 моль эквивалентов кислорода. Один моль эквивалентов кислорода при нормальных условиях занимает объем V эк (О2) = 22,4/4 = 5,6 л.
. Так, М (Н2) = 2 г/моль; М эк (Н2) = 1 г/моль. Следовательно, в одном моле молекул водорода Н2 содержится υ = 2/1 = 2 моль эквивалентов водорода. Как известно, моль любого газа при нормальных условиях (н.у.) (Т = 273 К, Р = 101,325 кПа) занимает объем 22,4 л. Значит, моль водорода займет объем 22,4 л, а так как в одном моле водорода содержится 2 моль эквивалентов водорода, то объем одного моля эквивалентов водорода равен V эк (Н2) = 22,4/2 = 11,2 л. Аналогично М (О2) = 32 г/моль, М эк (О2) = 8 г/моль. В одном моле молекул кислорода О2 содержится υ = 32/8 = 4 моль эквивалентов кислорода. Один моль эквивалентов кислорода при нормальных условиях занимает объем V эк (О2) = 22,4/4 = 5,6 л. численные значения, находим, что М эк (оксида) =
численные значения, находим, что М эк (оксида) = 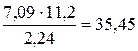 г/моль.
г/моль. = 3,5 г/моль. Находим объем, занимаемый молем эквивалентов азота (IV): 28 г/моль N2 – 22,4 л
= 3,5 г/моль. Находим объем, занимаемый молем эквивалентов азота (IV): 28 г/моль N2 – 22,4 л л.
л. ;
;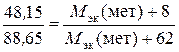 ,
,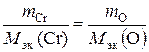 ; М эк (Cr) =
; М эк (Cr) =  г/моль.
г/моль. ,
,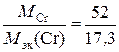 = 3.
= 3.


