Примечание об обозначении орбиталей.Представления, относящиеся к различным таблицам характеров, идентифицируются с помощью системы обозначений, которая содержит заглавные буквы (или греческие символы в случае линейных молекул). Тем не менее, при обозначении атомных орбиталей, к примеру, на диаграммах, общепринятым является использование строчных букв вместо заглавных. Поэтому индивидуальные (отдельные) d –орбитали в D4h окружении будут обозначаться как a1g + b1g + b2g +eg и s –орбитали как a1g. Из этого можно сделать два общих вывода: 1. s –орбитали центрального атома всегда преобразуются в соответствии с полностью симметричным представлением. 2. Другие орбитали центрального атома (т.е. p- или d-) преобразуются тем же образом, что и математические функции, которые возникают (проявляются) как их подписи (подстрочные индексы), обращая внимание на упрощение, которое делается в случае 2z 2- x 2 - y 2.
7.5 σ-связи в СН4. Теперь мы можем построить диаграмму молекулярных орбиталей для связывания в СН4. Это
делается путём комбинирования орбиталей центрального атома с орбиталями лигандов той же самой симметрии, и приводить к возникновению связывающих и антисвязывающих комбинаций. Валентные орбитали атома углерода (2 s и набор 2 p) в тетраэдрическом окружении преобразуются в a 1 и t2 соответственно. Набор из четырёх орбиталей атомов водорода преобразуется, соответственно в a 1 + t2, и на Рис. 7.7 показана диаграмма молекулярных орбиталей, описывающая эффект от комбинирования этих наборов атомных орбиталей. В метане в общем есть восемь валентных электронов, четыре - от атома углерода и по одному от четырех атомов водорода, и это как раз то количество кторое нужно, чтобы заполнить связывающие уровни a 1 + t2
7.6 Комбинации рσ орбиталей: σ-связи в XeF4 Приводившиеся ранее примеры показывают, каким образом набор s -орбиталей может
взаимодействовать с центральным атомом, образуя σ-связь, но p -орбитали с их лопастями, лежащими вдоль межъядерных осей (линий, соединяющих ядра атомов?) также могут принимать участие в σ-связывании, так как в этой ориентации они аксиально симметричны (осесимметричны) (так как в таком расположении?). На рис 7.8 показаны четыре p -орбитали атомов фтора в молекуле XeF4(D4h), которые лежат вдоль связей Xe-F. В такой пространственной ориентации ониведут себя как s -орбитали, и их представление Г p в D4h поэтому является идентичным выведенному ранее для валентных мод в XeF4: Г =a1g + b1g + eu Центральный атом ксенона имеет орбитали matching (подходящей) симметрии 5 s (a1g), 5 dx2-y2 (b1g) и пару 5 px, 5 py (eu), и, как и описанном выше примере для СН4, может быть построена диаграмма молекулярных орбиталей, в которой орбитали ксенона и фтора одной и той же симметрии взаимодействуют, образуя связывающие и антисвязывающие комбинации. На Рис. 7.9 показаны связывающие комбинации p - орбиталей ксенона и s -орбиталей фтора в системе σ -связей для XeF4.
7.7. Внеплоскостное связывание в XeF4
На рис 7.10 показана ориентация pz орбиталей четырёх атомов фтора в XeF4, и очевидно что
они не предполагают возможность внеплоскостного π-связывания для (что ксасется, по отношению) к одинарной Xe-F связи. Однако, для того, чтобы установить симметрию любых возможных молекулярных π -связей, мы должны получить неприводимое представление для Гπ в точечной группе D4h. Характеры для матриц, составляющих Гπ получены обычным образом, при рассмотрении эффекта, оказываемого различными операциями симметрии на четыре pz орбитали, при этом помня, что орбитали фтора, находящиеся вне плоскости могут менять свой знак, (переворачиваться?) при таких операциях симметрии как σh. Используя разработанную (принятую) ранее (см. Рис. 1,12) ориентацию молекулы, получаем:
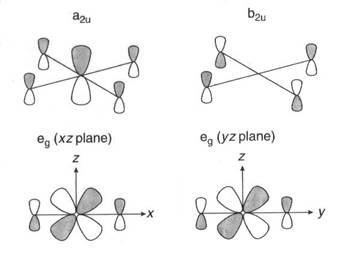
Что сводится к Гπ =a2u + b2u + eg Таблица характеров группы D4h показывает, что для того, чтобы взаимодействовать с этими комбинациями pz орбиталей атомов фтора, (правильную) подходящую симметрию имеют такие орбитали центрального атома ксенона: 5 pz (a2u) и пара орбиталей 5 dxz и 5 dyz, которые вместе преобразуются в eg. У атома ксенона нет орбиталей с симметрией b2u. На Рис. 7.11 показаны a2u и eg комбинации атомных орбиталей, которые приводят к net связыванию, а также несвязывающие b2u комбинации орбиталей F.
7.8 σ- и π- орбитали лигандов в октаэдрических комплексах МХ6 И, наконец, в этой главе мы рассмотрим возможности σ- и π-связывания в октаэдрических
комплексах переходных металлов с точки зрения симметрии. Так же, к и в приведенных ранее примерах, π-орбитали лигандов опять обычно являются p -орбиталями, перпендикулярными σ-связи, но так как s - и p - орбитали центрального атома уже полностью вовлечены в σ-систему, мы можем ожидать, что любое π-связывание должно включать в себя d- орбитали металла. Для начала нужно понять, что каждый лиганд Х в общем имеет одну доступную p -орбиталь σ-симметрии, которая направлена к центральному атому М и которая будет вовлечена в σ-связь, и две других p -орбитали, перпендикулярных к связи М-Х, которые доступны для π-связывания. Расположение этих p -орбиталей относительно связи М-Х показано на рис 7.12. В общем, существуют шесть лигандов, координированных к (связанных с) к металлу, и, следовательно, есть шесть р- орбиталей лигандов, которые могут принимать участие в σ-связывании, и 12 р- орбиталей лигандов в возможной π-системе. Можно принять, что представление для σ-связывания лигандов, Гσ идентично Гstretch для МХ6. Оно было выведено ранее как Г stretch = А1g + Еg + T1u (часть 6), и, применяя этот результат к σ -орбиталям, мы должны только помнить об обозначениях строчными буквами. Следовательно Гσ = a1g + eg + t1u. Центральный атом может предоставлять орбитали с такой симметрией и на Рис. 7.13 показаны σ-связывающие комбинации лигандов и орбиталей металла.
Представление Гπ можно получить, рассматривая эффект оказываемый различными операциями симметрии точечной группы Оh на 12 р -π орбиталей лигандов, и затем приводя получившееся представление с помощью формулы приведения. Эта процедура работает удовлетворительно, но есть ряд альтернативных и более быстрых методов, которые используют тот факт, что р -орбитали атомов преобразуются (трансформируются) таким же образом, как и смещения атомов x, y и z. Отсюда, для каждого лиганда Х Гp = Гmol Если мы определим ГХ как представление для всех 18 р -орбиталей Х-лигандов, тогда ГХ = Гσ + Гπ Тем не менее, из-за эквивалентности р- орбиталей и x, y и z, ГХ эквивалентно ранее рассчитанному Гmol для набора из шести атомов лигандов Х. Поэтому нам нужно только рассчитать Гmol для шести атомов лигандов, а затем получим Гπ из равенства Гπ = Гmol – Гσ. Зная число несмещённых атомов и вклад от несмещённого атома мы, используя описанный в части 5 способ, получим Гmol в таком виде:
Что может быть упрощено с помощью формулы приведения, приводя нас к выражению: Гmol = a1g + eg + t1g + t2g + 2t1u + t2u Представление Гσ выведено как a1g+eg+t1u, и комбинация симметрии для 12 орбиталей лигандов, способных участвовать в π-связывании поэтому выглядит как: Гπ = t1g + t2g + t1u + t2u
7.9 Схема связывания с помощью молекулярных орбиталей для МХ6 Свойства симметрии s-, p- и d- орбиталей центрального атома, полученные из таблицы характеров точечной группы Оh были описаны ранее. Из этой таблицы можно сделать вывод, что они преобразуются в a1g, t1u и (eg+t2g) соответственно, и, зная это теперь возможно постороить диаграмму молекулярных орбиталей для МХ6. На рис 7.14 показано как это может быть полностью завершено:
Заключение Основной задачей этой части было продемонстрировать, как можно строить схемы связывания с помощью молекулярных орбиталей, путём анализа симметрии участвующих наборов атомных орбиталей. Тем не менее, хотя общий результат заключается в том, что каждая орбиталь, которую можно идентифицировать имеет отличную от других энергию, рассмотрение симметрии не даёт никакой достоверной (надёжной) количественной информации, касающейся энергий этих орбиталей. В этом отношении ситуация подобная тому, что происходит в колебательной спектроскопии. Но очевидным, однако, стал тот факт, что одинаковые представления возникали (появлялись, обнаруживались, находились) точно так же, как и в предыдущих частях, описывающих молекулярные колебания. Эта распространённая взаимосвязь является одним из наиболее интересных и используемых аспектов симметрии, и одной из главных задач этого пособия было продемонстрировать, как широко может распространяться подход, основанный на принципах симметрии. Финальные (последние) упражнения, приведенные дальше? разработаны затем, чтобы объединить (организовать, обобщить_ материал, изложенный в этой части.
|