Задачи для самостоятельного решения70. Написать выражения констант химического равновесия КС и Кр для обратимых реакций: 2А(г) + В(г) <=> С(г); СО(г) + Сl2(г) <=> COCl2(г); C(к) +2Н2(г) <=> СН4(г); 4НСl(г) + О2(г) <=> 2Н2О(г) + 2Сl2(г); 2NО2(г) <=> 2NO(г) + О2(г). 71. Вычислить константу равновесия КС реакции А + 2В <=> С, если равновесные концентрации (моль/л): [А]=0,12; [В]= 0,24; [С]= 0,295. 72. Равновесие в реакции 2NО2(г) <=> 2NO(г) + О2(г) установилось при концентрациях (моль/л): [NО2]= 0,03; [NO]= 0,09; [О2]= 0,2. Вычислите КС этой реакции. 73. Реакция СО(г) + Сl2(г) <=> COCl2(г) протекает в объёме 20 л. Состав равновесной смеси 0,28 г СО; 0,355 г Сl2; 0,495 г COCl2. Вычислите КС. 74. В сосуд объёмом 2 л помещено 0,53 моля водорода и 0,3 моля азота. К моменту равновесия образовалось 0,02 моля аммиака. Вычислите КС. 75. Вычислите КС реакции Н2 + I2 <=> 2HI, происходящей в сосуде объёмом 2 л, если начальные количества веществ были следующими: 0,2 г водорода и 12,7 г йода и к момонту равновесия прореагировало 20 % водорода. 76. Вычислите равновесные концентрации водорода и иода в реакции Н2 + I2 <=> 2HI, если их начальные концентрации составляли 0,7 и 1,6 моль соответственно, а равновесная концентрация иодоводорода равна 0,8 моль/л. Вычислите КС. 77. Равновесные концентрации веществ в обратимой реакции 2SO2 + O2 <=> 2SO3 составляют (моль/л): [SO2] – 0,0002, [O2] – 0,004, [SO3] – 0,003. Вычислите КС и исходные концентрации диоксида серы и кислорода. 78. Равновесные концентрации веществ в обратимой реакции N2 + 3H2 <=> 2NH3 составляют (моль/л): [N2] – 0,0002, [H2] – 0,004, [NH3] – 0,003. Вычислите КС и исходные концентрации азота и водорода. 79. Вычислите равновесные концентрации водорода и иода в реакции Н2 + I2 <=> 2HI, если их начальные концентрации составляли 1,2 и 0,8 моль/л соответственно, а равновесная концентрация иодоводорода равна 0,8 моль/л, а в реакцию вступило 50 % водорода. Вычислите КС. 80. Равновесный состав газовой смеси, в которой протекает реакция 2NO(г)+О2(г) <=>2NО2(г), составляет (об. %): NO = 44 %, О2 = 20 %, NО2 = 36 %, давление равно 1,05∙105 Па, температура 298 К. Вычислите Кр и Кс реакции. 81. Константа равновесия Кр реакции, протекающей в газовой смеси 2SO2+O2 <=>2SO3 при 1000 К, равна 3∙10-2. Вычислите Кс реакции. 82. Как повлияет а) повышение t; б) понижение давления на равновесие в реакциях: 1) 2Н2 + О2 <=> 2 Н2О + Q; 2) N2 + О2 <=> 2 NО – Q; 3) N2 + 3H2 <=> 2NH3 +Q; 4) 2NO2 <=> N2О4+ Q; 5) 2CO + O2 <=> CО2+ Q; 6) 2Н2S<=> 2Н2 +S2 – Q. 83. Равновесие в реакции СО+Сl2<=>СОСl2 установилось при концентрациях [СО] – 0,15; [Сl2] – 0,08; [СОСl2] – 0,3 моль/л. Вычислите равновесные концентрации веществ после увеличения концентрации хлора до 0,1 моль/л. 84. Как повлияет а) повышение давления, б) повышение температуры на равновесие в следующей системе: 2HBr <=> H2 +Br2, ΔH=70,3 кДж?
ГЛАВА 4. Строение атома и периодический закон
§ 4. 1. Строение атомного ядра
По современным представлениям, ядра атомов состоят из протонов и нейтронов, общее название которых нуклоны. Протон (р) и нейтрон (n) – элементарные частицы, обладающие практически одинаковой массой, но различным зарядом: нейтрон имеет массу 1,0087 а.е.м. и заряд q = 0 (10n), а протон имеет массу 1,0073 а.е.м. и заряд q = + 1,6·10-19 Кл или + 1 (в относительных единицах) (11р), в связи с чем ядро атома заряжено положительно. Химические элементы в таблице Д.И. Менделеева расположены в порядке возрастания положительного заряда их ядер, выраженного в относительных единицах, а положительный заряд ядра определяется числом протонов в нём, поэтому порядковый номер химического элемента указывает число протонов в ядре (Z): №(Э) = Z. Чтобы атом был электронейтрален, положительный заряд ядра должен компенсироваться отрицательным зарядом электронов. Заряд электрона равен -1.6·10-19 Кл или –1 (в отн.ед.), следовательно, общее число электронов в электронной оболочке атома N(e) равно числу протонов в ядре и порядковому номеру химического элемента: № (Э) = N(e) = Z. Так как практически вся масса атома сосредоточена в ядре и mp ≈ mn ≈ 1 а.е.м., то округленное значение Аr химического элемента равно общему числу нуклонов в ядре:
А = N + Z, (4.1)
где N – число нейтронов в ядре, Z – число протонов в ядре, A – округленное значение Аr данного химического элемента, называемое массовым числом. Формула (4.1) позволяет вычислять число нейтронов в ядре. Например, округленное значение относительной атомной массы натрия Аr (Na) = 23, порядковый номер – 11, следовательно число протонов в ядре атома натрия Z = 11, а число нейтронов высчитывается по формуле: N (Na) = A(Na) – Z(Na) =23 – 11 =12. Существуют ядра с одним и тем же значением Z, но с различным значением A r, т.е. их ядра содержат разное число нейтронов. Такие атомы называются изотопами. Так, символами 12 6С и 13 6С обозначают изотопы углерода.
§ 4. 2. Электронные конфигурации атомов и ионов
I. Строение электронной оболочки
Современная теория строения атома опирается на квантовую механику, согласно которой электрон обладает одновременно и свойствами частицы (имеет массу покоя) и свойствами волны (его движение можно охарактеризовать длиной волны, амплитудой, частотой). Поэтому нельзя говорить о какой-то траектории (орбите) движения электрона в атоме. В связи с этим, введено понятие “электронное облако” и ”орбиталь”. Орбиталь – это часть атомного пространства, в которой вероятность нахождения электрона наибольшая (90%). Электронные конфигурации атомов и простых одноатомных ионов принято обозначать указаниями на значение главного квантового числа n, орбитального квантового числа l и магнитного квантового числа ml. Окружающие ядро электроны располагаются по слоям (энергетическим уровням). Каждый энергетический уровень характеризуется определенным значением n, равным номеру уровня. Главное квантовое числодля атомов известных химических элементов имеет семь значений: 1, 2, 3, 4, 5, 6, 7. Число энергетических уровней в атоме равно номеру периода, в котором элемент расположен. Максимально возможное число электронов (N) на данном энергетическом уровне определяется по формуле: N = 2n2, где n - номер уровня. Уровень, на котором находится максимально возможное число электронов, называется завершенным. Завершение внешнего уровня наступает при 8 электронах. Исключение составляют атомы водорода и гелия, у которых завершение наступает при двух электронах. Электроны на энергетических уровнях обладают разным запасом энергии: наименьшее значение – у электронов первого уровня и т.д. Электроны образующие один и тот же слой, несколько отличаются друг от друга энергией, или говорят, что энергетические уровни расщепляются на подуровни. Энергию электрона на подуровне характеризует орбитальное квантовое число, которое имеет четыре значения (0, 1, 2, 3). Подуровень, характеризующийся значением l =0, называется s -подуровнем, l =1 – p -подуровнем, l =2 – d -подуровнем и l =3 f -подуровнем. Первый уровень имеет только s -подуровень, второй расщепляется на s - и р - подуровень, третий – на s - p - и d - подуровень, четвертый уровень расщепляется на s - p - d - и f – подуровни‚ пятый‚ шестой и седьмой уровни помимо s - p - d - и f – подуровней имеют другие подуровни.
Е
Каждому значению l отвечает определенный набор значений магнитного квантового числа m l. В соответствии с этим каждый энергетический подуровень содержит определенное число орбиталей: s -подуровень состоит из одной орбитали, p -подуровень – из трех, d -подуровень – из пяти, f -подуровень – из семи орбиталей. Графически орбиталь изображают в виде, так называемой квантовой (энергетической) ячейки.
Число электронов на одной орбитали определяется числом значений спинового квантового числа (ms)‚ которое принимает всего 2 значения‚ т. е. на одной орбитали не может быть более двух электронов. Электрон со спиновым квантовым числом +1/2 условно обозначают ↑, а со спиновым квантовым числом -1/2 ↓. Одну орбиталь могут занимать только электроны с антипараллельными (противоположными) спинами ↑↓. II. Порядок заполнения электронами уровней и подуровней Порядок заполнения электронами атомных орбиталей определяется принципом наименьшего запаса энергии. В соответствии, с которым заполнение электронных слоев начинается с уровней и подуровней, характеризующихся самой низкой энергией (правило Клечковского). Последовательность заполнения электронами уровней и подуровней имеет вид: 1s→2s→2p→3s→3р→4s→3d→4p→5s→4d→5p→6s→4f→5d→6p→7s….. Заполнение электронами атомных орбиталей одного подуровня подчиняется правилу Хунда: атом имеет устойчивое состояние, если на одном подуровне электроны располагаются так, что модуль суммы спиновых квантовых чисел электронов максимален. Например‚ р -орбиталь заполняется
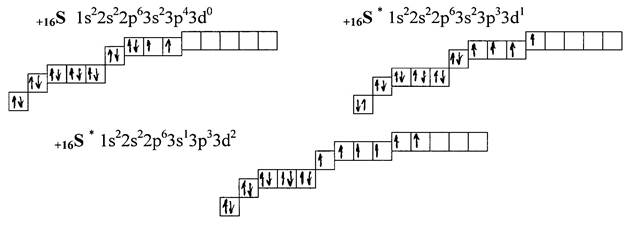
В соответствии с принципом Паули в атоме не может быть двух электронов с одинаковым набором квантовых чисел. Если два электрона занимают одну обиталь, т.е. имеют одинаковое значение n, l и ml, то их спиновые квантовые числа должны быть различными. То есть одну орбиталь могут занимать только электроны с антипараллельными (противоположными) спинами ↑↓. II. Электронные формулы Структура атома с распределёнными по уровням, подуровням и орбиталям электронами называется электронной конфигурацией атома. Электронная конфигурация атома показывает распределение электронов по уровням и подуровнями может быть записана в виде электронной формулы. При составлении электронной формулы · вначале цифрой указывают номер уровня (значение n) · затем буквами s, p, d, f – значение l · у буквы сверху справа – число электронов на данном подуровне. Например, в основном состоянии электронная формула атомов азота – +7N 1s22s22p3, серы – +16S 1s22s22p63s23p43d0, натрия – +11Na 1s22s22p63s13p03d0, марганца – +25Mn 1s22s22p63s23p64s23d54p04d04f0. На основании того, какой подуровень заполняется последним (s -, p -, d - или f-) в атоме, химические элементы подразделяют, соответственно, на s -элементы, p -элементы, d -элементы или f -элементы. Так азот и сера относятся к р -элементам, натрий – s -элемент, а марганец – d -элемент. Электроны последнего (для s - и р -элементов) или последнего и предпоследнего (для d - и f -элементов) называются валентными. Их число соответствует максимальной валентности элемента и равно номеру группы, в которой расположен элемент. Так у азота 5 валентных электронов, у серы – 6, у натрия – 1, у марганца – 7. VI. Электронно-графические формулы и возбужденное состояние атома Распределение электронов по уровням можно изобразить с помощью электронно-графических формул, показывающих энергетические орбитали каждого из подуровней, их число, а также электроны, расположенные на них. Эти формулы составляются в соответствии и рассмотренными выше правилами Клечковского, Хунда и Паули. Так, например, электронно-графическая формула для азота и натрия имеет следующий вид:
При определенных условиях, в частности при образовании химической связи, атом химического элемента может переходить в возбужденное состояние (состояние с более высокой энергией), которое сопровождается распариванием спаренных электронов и переходом их на свободные орбитали более высоких энергетических подуровней. Распаривание электронов может проходить только внутри одного последнего (внешнего) уровня (для s - и p -элементов), либо с участием электронов последнего (внешнего) и предпоследнего (предвнешнего) уровней (для d - и f- элементов). Таким образом, условием перехода атома в возбужденное состояние является совокупность двух факторов: 1) наличие спаренных электронов на последнем уровне (для s - и p -элементов) или на последнем и предпоследнем уровне (для d - и f -элементов); 2) наличие свободных орбиталей на последнем уровне (для s - и p -элементов) или на последнем и предпоследнем уровне (для d - и f -элементов). Возбужденное состояние атома принято изображать звездочкой (*) в правом верхнем углу около знака химического элемента, например, S*. В соответствии с вышесказанным возможность перехода рассмотренных ранее элементов распределяется следующим образом: для атомов азота и натрия переход в возбужденное состояние невозможен, так как у азота при наличии двух спаренных s-электронов нет свободных орбиталей, а у атома натрия при наличии свободных орбиталей нет спаренных электронов. У серы возможных возбуждённых состояний два, так как есть две пары спаренных электронов и пять свободных орбиталей:
Таким образом, сера может проявлять в соединениях три валентности: в соответствии с основным состоянием валентность серы равна двум (II), в соответствии с первым возбужденным состоянием – IV и в соответствии со вторым возбужденным состоянием – VI.
V. Электронная конфигурация ионов
Ионы – это заряженные частицы: положительно заряжены (+) – катионы, отрицательно заряжены (–) – анионы. Электронейтральные атомы химических элементов приобретают заряд в следствие потери имеющихся или приобретения новых электронов в результате образования химической связи. Заряд ядра при этом не меняется. При недостатке электронов атом приобретает положительный заряд, т.е. становится катионом, а при избытке электронов атом приобретает отрицательный заряд, т.е. становится анионом. Так, например, электронная конфигурация атома магния: +12Mg 1s22s22p6 3s2 3p03d0; катиона магния: +12Mg 2+ 1s22s22p6 3s0 3p03d0; атома хлора: +17Cl 1s22s22p63s2 3p5 3d0; аниона хлора: +17Cl1-1s22s22p63s2 3p6 3d0. Задачи для самостоятельного решения 85. Существуют ли элементы, ядра атомов которых содержали бы протонов больше, чем нейтронов? Ответ поясните‚ используя Периодическую систему элементов Д. И. Менделеева. 86. Пользуясь Периодической системой Д. И. Менделеева вычислить число протонов, нейтронов и электронов в атомах титана, натрия, германия, хрома, кислорода, хлора и серы. 87. Символ изотопа хрома 5224Cr. Сколько протонов и нейтронов в ядре и сколько электронов в оболочке, написать электронную формулу атома. 88. Ядро атома содержит 10 нейтронов, электронная оболочка – 9 электронов. Какой это элемент? 89. Массовое число атома элемента равно 181 у.е. в электронной оболочке атома 73 электрона. Указать сколько нейтронов и протонов в ядре, определить элемент и написать его электронную формулу. 90. Написать электронные структуры в основном и возбужденном состоянии атомов калия, фосфора, алюминия, хрома и титана и определить по ним возможные валентности. 91. Сколько валентных электронов содержат атомы с порядковыми номерами 17, 21, 31, 50, 23, 35, 41, 42. Составить их электронные формулы. 92. Внешний электронный слой атома элемента 3s23p4. Определите элемент. 93. Внешний электронный слой атома элемента 2s22p1. Определите элемент. 94. Внешний электронный слой атома элемента 3d34s2 Определите элемент. 95. Сколько электронов отдают атомы элементов при превращениях Fe→Fe2+, Fe2+→Fe 3+, Ag→Ag+. Составьте электронные формулы атомов и ионов. 96. Сколько электронов приобретают ионы при процессах S6+→S2-, Cl5+→Cl+, Ba2+→Ba. Составьте формулы частиц. 97. Какие из ионов Sb3+, Te2-, I-, Cs+ сходны по строению электронной оболочки с Xe? 98. Какие из ионов Rb+, Se2+, Br -, Se4+ сходны по строению электронной оболочки с Kr? 99. Сколько заполненных электронных слоев имеется у частиц С, С2+, С4+, С 4 -. 100. Сколько заполненных электронных слоев имеется у частиц Mn0, Mn2+, Mn4+, Mn7+. 101. Написать электронные формулы частиц Ti4+, Ti3+, V5+, Sn2+, O2-, Br -, N3 -, P3 -.
§ 4. 3. Энергия ионизации, сродство к электрону и электроотрицательность
Атомы химических элементов состоят из положительно заряженного ядра и окружающих их отрицательно заряженных электронов. Атом в целом электронейтрален, так как положительный заряд ядра численно равен сумме окружающих его электронов. При получении электронами, находящимися на внешнем (s - и p -элементы) или предвнешнем (d - и f -элементы) энергетическом уровне энергии, возможен переход их на иной энергетический уровень, при этом прочность их связи с ядром уменьшается. Энергия, необходимая для удаления электрона на бесконечно большое расстояние от ядра, называется энергией ионизации или потенциалом ионизации (I). При этом нейтральный атом превращается в положительно заряженный ион: А0 + I = А+ + e- где А0 – нейтральный атом, А+ – положительно заряженный ион, e- - электрон, I – энергия ионизации. Величина энергии ионизации по периоду слева направо увеличивается, вследствие увеличения силы притяжения между электронами, находящимися на внешнем или предвнешнем энергетическом уровне, и ядром, заряд которого при перемещении по Периодической системе Д. И. Менделеева растет, а число энергетических уровней остается неизменным. Величина энергии ионизации по группе сверху вниз уменьшается, вследствие увеличения числа энергетических уровней – расстояния между электронами внешнего и предвнешнего энергетического уровня и ядром, что уменьшает силу притяжения между ними и как следствие облегчает возможность отрыва электрона от электронейтрального атома. Наименьшим значением энергии ионизации обладают атомы щелочных металлов, наибольшим – атомы галогенов и благородных газов. Величина I является мерой металличности элемента. Атомы элементов могут присоединять электроны, превращаясь в отрицательно заряженные ионы. Энергия, выделяющаяся при присоединении электрона к электронейтральному атому, называется сродством к электрону или энергией сродства к электрону (Е).
А0 + e – = А – + Е где А0 – нейтральный атом, А– – отрицательно заряженный ион, e ––электрон, Е – энергия сродства к электрону. Величина энергии сродства к электрону тем выше, чем легче присоединить электрон к электронейтральному атому. Так при передвижении по Периодической системе Д. И. Менделеева слева направо сила взаимодействия между ядром и электронами увеличивается, что облегчает возможность присоединения электрона‚ т. е. энергия сродства к электрону увеличивается. По группе сверху вниз величина энергии сродства к электрону уменьшается. Сродство к электрону наиболее велико у галогенов и элементов подгруппы кислорода. Энергия сродства к электрону является мерой неметалличности элемента. Величина, которая позволяет учесть способность нейтрального атома, как к присоединению, так и к отдаче электрона называется электроотрицательностью (Э. О.) иобозначается буквой χ ( хи). Обычно для определения электроотрицательности используют шкалу Л. Полинга (приложение‚ таблица 3). Наименьшее значение электроотрицательности имеют атомы щелочных металлов, наибольшее – атомы галогенов. Самым электроотрицательным элементом является фтор, далее по группе сверху вниз и по периоду справа налево электроотрицательность падает. Энергия ионизации, сродство к электрону и электроотрицательность измеряются обычно в электронвольтах (эВ) или в килокалориях (1 ккал = 4,184 кДж), 1эВ =1,6·10-12эрг = 23060 кал/ моль = 96,48 кДж/моль.
|


 Схема расщепления энергетических уровней на подуровни
Схема расщепления энергетических уровней на подуровни
 f -подуровень
f -подуровень

 4 d -подуровень
4 d -подуровень

 p -подуровень
p -подуровень



 Число неспаренных электронов на последнем энергетическом уровне (для s- и p-элементов) соответствует валентности химического элемента в данном состоянии. Так, валентность азота составляет III, а валентность натрия – I.
Число неспаренных электронов на последнем энергетическом уровне (для s- и p-элементов) соответствует валентности химического элемента в данном состоянии. Так, валентность азота составляет III, а валентность натрия – I.