I1, эВ 24.6 21.6 15.8 14.0 12.1
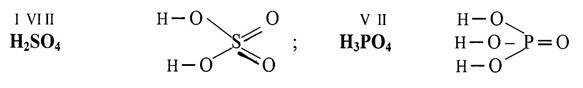
ГЛАВА 5. Химическая связь. Строение молекул § 5. 1. Валентность и степень окисления Способность атома химического элемента присоединять или замещать определенное число атомов другого элемента с образованием химической связи называется валентностью элемента. Валентность равна числу химических связей, которыми атом химического элемента связан с атомами других элементов в химическом соединении. Валентность выражается целым положительным числом, лежащим в интервале от I до VIII. Валентности, равной 0 и больше VIII нет. Постоянную валентность проявляют водород (I), кислород (II), щелочные металлы – элементы первой группы главной подгруппы (I), щелочноземельные металлы – элементы второй группы главной подгруппы (II). Атомы большинства элементов могут проявлять в соединениях высшую валентность, равную номеру группы, низшую валентность, равную 8 – № (группы) и промежуточные валентности, лежащие в полученном интервале. Например, высшая валентность серы равна VI, низшая – II, а промежуточная – IV. Формулы, которые показывают порядок соединения атомов в молекуле и валентность каждого элемента называют графическими. В графических формулах химическая связь обозначается черточкой (─). Например, графические формулы серной и фосфорной кислоты, составленные в соответствии с валентностью, имеют вид:
Степень окисления (С.О.) – это заряд иона элемента в соединении, вычисленный исходя из предположения, что молекула состоит только из ионов. Степень окисления обозначается римскими цифрами со знаком + или – и приводится в правом верхнем углу около атома элемента. Правила определения степени окисления химических элементов в соединениях 1. Степень окисления любого элемента в простом веществе равна 0. 2. Сумма степеней окисления всех атомов, входящих в состав частицы (молекулы, иона и т.д.) равна заряду этой частицы. В частности, сумма степеней окисления всех атомов в составе нейтральной молекулы равна 0. Сумма степеней окисления всех атомов в составе иона равна заряду иона, так сумма зарядов атомов азота и кислорода в ионе NO3 1- равна «–1». 3. Если соединение образовано двумя элементами, то у элемента с большей электроотрицательностью степень окисления меньше 0, а у элемента с меньшей электроотрицательностью – больше 0. 4. Максимальная положительная степень окисления любого элемента равна номеру группы в Периодической системе, а минимальная отрицательная равна (номер группы – 8). 5. Степень окисления фтора в соединениях равна «–1»‚ включая соединения кислорода. 6. Степень окисления щелочных металлов (Li, Na, K, Rb, Cs), равна «+1». Степень окисления металлов второй группы главной подгруппы (Mg, Ca, Sr, Ba) равна «+2». Степень окисления алюминия равна «+3». 7. Степень окисления водорода в соединениях равна «+1» (искл. гидриды ЭxНy, где ст.ок. водорода равна «–1») 8. Степень окисления кислорода в большинстве соединениий равна «–2»‚ в Н2О2 и пероксидах металлов равна «–1»‚ в соединениях со фтором – «+1» (О2F2) и «+2» (OF2). · Если оказывается, что одно правило противоречит другому, то предпочтение отдается правилу с наименьшим порядковым номером. · Степень окисления не всегда совпадает по абсолютной величине с валентностью. Пример 1. Определить степень окисления атомов в составе следующих химических соединений: а) KMnO4, б) NH3, в) Al2 (SO4)3. Решение: а) Калий и кислород имеют степень окисления равную +1 и –2, соответственно; марганец может иметь в химических соединениях различную степень окисления. Степень окисления марганца вычислим согласно первому пункту правил, который гласит, что молекула в целом электронейтральна. K +1MnO4-2 +1∙1+(+x)+(-2∙4) = 0, т.е X = +7 ═> K +1Mn +7O4-2. б) Водород имеет степень окисления +1, следовательно, N H3+1 x + (+1∙3) = 0, т.е. x = -3 ═> N -3H3+1 в) Алюминий и кислород имеют степень окисления равную +3 и –2, соответственно‚ следовательно, Al2+3 (S O4-2)3 (+3∙2) +(3∙x) +(-2∙12)=0, т.е. x = +6 ═> Al2+3 (S+6 O4-2)3
Задачи для самостоятельного решения 107. Определите валентность и степень окисления элементов, и назовите вещества KNO3, Na2SiO3, H2SiO3. 108. То же для HCl, HClO, HСlO2, HСlO3, HСlO4. 109. Дать графическое изображение строения молекул CO2, CH4, CH3OH и определить валентность и степень окисления элементов. 110. Определить валентность и степень окисления марганца в MnO, MnO2, Mn2O3‚ Mn2O7‚ MnO3. 111. Определить валентность и степень окисления в молекулах PH3, H2O, CaH2. 112. Определить валентность и степень окисления железа в оксиде железа (II), оксиде железа (III) и в сложном оксиде Fe3O4 (FeO∙Fe2O3). 113. Определите валентность и степень окисления и составьте структурные (графические) формулы NH3, NH2OH, HNO2, HNO3. 114. Определите валентность и степень окисления химических элементов и составьте структурные (графические) формулы для оксида хрома (III), оксида хрома (VI), хромата калия и бихромата калия. 115. Определите валентность и степень окисления элементов в соединениях и назовите вещества: K2[PtCl6], K3[AlF6], H[BF4], Na2[SiF6]. 116. Определите валентность и степень окисления элементов в тетрагидроксоалюминате калия, гексацианоферрате (III) калия, гексацианоферрате (II) натрия. 117. Определите валентность и степень окисления углерода в C2N2, CH3CH2OH, (CH3)2O и CH3COOH. 118. Определите степень окисления элементов в следующих веществах: LiCl, Li2SO4, Li3N, LiNO3. 119. Определите степень окисления элементов в следующих веществах: сульфит натрия, бромид бария, фосфат железа (II), гидрокарбонат кальция, перхлорат магния. 120. Определите какой металл, проявляющий степень окисления +4, образует оксид с массовой долей кислорода 40%. 121. Сера в соединении со фтором проявляет высшую положительную степень окисления. Рассчитайте массу газообразного фторида серы объемом 1 л (н.у.) и его плотность по водороду.
§ 5. 2. Основные типы химической связи
Химическая связь между атомами в молекуле, согласно теории Льюиса, возникает при образовании общих электронных пар. Различают два крайних случая расположения электронных пар между атомами. В первом случае электронные пары располагаются на одинаковом расстоянии между атомами (в случае атомов с одинаковой величиной электроотрицательности), такая связь называется ковалентной неполярной, во втором случае электронные пары принадлежат одному из атомов (более электроотрицательному), такая связь называется ионной. Если электронная пара лишь несколько оттянута к одному из атомов (при небольшом отличии в электроотрицательностях), то связь ковалентная полярная. Ионная связь обычно образуется между атомами металлов и неметаллов (Na+Cl-). При соединении атомов неметаллов между собой возникает ковалентная связь с различной степенью полярности. Полярность химической связи можно определить по разнице электроотрицательностей элементов (∆ χ) ее образующих (см. приложение‚ таблица 3). Чем больше ∆ χ, тем больше полярность связи. Пример 1. Указать тип химической связи в молекулах: а) NaBr, б) CO, в) O2, г) NO2. Решение: Воспользуемся таблицей электроотрицательностей (см. приложение‚ таблица 3). а) NaBr: величины электроотрицательностей отличаются очень резко: χ(Na)=0.9, χ(Br)=2.8, т.е. ∆ χ=1,9, следовательно, связь ионная; б) СО: электроотрицательности углерода и кислорода отличаются и они оба неметаллы: χ(С)=2,5, χ(О)=3,5, т.е ∆ χ = 1, следовательно, связь ковалентная полярная; в) О2: ∆ χ=0, следовательно, связь ковалентная неполярная; г) NO2: электроотрицательности азота и кислорода отличаются, и они оба неметаллы: χ(N)=3,0, χ(О)=3,5, т.е ∆ χ = 0‚5, следовательно, связь ковалентная полярная. Задачи для самостоятельного решения 122. Определить вид связи в следующих соединениях: иодид рубидия, йодоводород, оксид фосфора (III), хлорид магния, азот. 123. Расположите соединения в ряд по возрастанию степени ионности: хлорид цезия, оксид азота (II), бромид алюминия, оксид калия, кислород, трихлорид фосфора. 124. Пользуясь графическими формулами‚ укажите‚ в сторону‚ какого атома будут смещаться электроны в соединениях NH3, CaCl2, Al2O3, BaS, H2O2, H2O, SiF4. 125. Как будет меняться характер связи в ряду NaCl ―MgCl2― AlCl3― SiCl4― PCl5― SCl2― Cl2? 126. Как будет меняться характер связи в ряду Li2O―BeO―B2O3―CO2―N2O5―Cl2O7? 127. В сторону какого атома смещена электронная пара в кислородных соединениях водорода, фтора, кальция, углерода (IV), натрия? 128. В сторону какого атома смещена электронная пара в водородных соединениях кальция, фтора, углерода (IV), натрия? 129. Какая из химических связей Н―Сl, Н―Br, Н―I, Н―S, Н―P является более полярной? Укажите, в какую сторону смещается электронная плотность связи.
ГЛАВА 6. Коллоидные растворы
Дисперсные системы. Большинство дисперсных систем являются лиофобными. Для них характерны: гетерогенность‚ наличие чёткой выраженной межфазной границы; высокая степень раздробленности дисперсной фазы; процесс диспергирования является несамопроизвольным‚ требует затрат энергии; наличие избытка свободной поверхностной энергии‚ что обусловливает стремление к коагуляции. Свойства лиофобных систем принципиально отличаются от от свойств лиофильных систем. Для лиофильных систем характерны: самопроизвольное‚ часто с выделением энергии‚ образование систем; сильное межмолекулярное взаимодействие между частицами дисперсной фазы и дисперсионной среды; очень малое межфазовое поверхностное натяжение и размытая межфазовая граница; термодинамическая устойчивость (постоянные во времени концентрации и размеры частиц). Коллоидные растворы. Коллоидное состояние характерно для многих веществ, если их частицы имеют размер от 1 нм до 10 мкм. Поверхностный слой характеризуется поверхностной энергией и способностью адсорбировать те или иные частицы, в том числе ионы из раствора. Существуют лиофильные (гидрофильные) коллоиды, в которых растворитель взаимодействует с ядрами частиц, и лиофобные (гидрофобные) коллоиды, в которых растворитель не взаимодействует с ядром частиц. Характерной особенностью гидрофобных коллоидных частиц является наличие на их поверхности заряда, обусловленного избирательной адсорбцией ионов. Коллоидная частица имеет сложное строение. Она включает в себя ядро, адсорбированные ионы, противоионы и растворитель. Растворитель входит в состав гидрофобных частиц лишь как сольватная оболочка адсорбированных ионов или при наличии стабилизаторов (ПАВ), имеющих лиофобную и лиофильные части. Примеры строения гидрофобных коллоидных частиц:
Как видно, ядро состоит из электронейтрального агрегата частиц с адсорбированными ионами элементов, входящих в состав ядра (в данных примерах ионами Ag+, HS–, Fe3+). Гидрофобная коллоидная частица кроме Методы получения коллоидных растворов. Для приготовления коллоидных растворов следует получить частицы размером от 1 нм до 10 мкм, подобрать дисперсионную среду, в которой не растворяется вещество частиц, и обеспечить устойчивость частиц. В качестве вещества коллоидных частиц в водных средах служат металлы, оксиды‚ гидроксиды, сульфиды и другие малорастворимые соединения металлов и неметаллов. Частицы соответствующих размеров получают либо измельчением крупных частиц до агрегатов коллоидных размеров (диспергирование), либо объединением (конденсацией) атомов, молекул, ионов. В диспергационных методах применяют различные диспергаторы, например‚ коллоидные мельницы. Во конденсационных методах обычно используют методы осаждения: гидролиз, окисление, восстановление, нейтрализация. Например, в результате гидролиза солей железа (III) получают его гидроксид: Fe3+ + 3H2O = Fe(OH)3 + 3 H+ Строение и заряд коллоидных частиц. Поскольку коллоидные системы являются системами гетерогенными, на поверхности различных фаз возможно образование зарядов, противоположных по знаку, т. е. возможно возникновение двойного электрического слоя на границе раздела фаз. Образование этого слоя на коллоидной частице AgI можно KI + AgNO3 → AgI + KNO3 Из т молекул AgI возникают микрокристаллики размерами в пределах коллоидных частиц, образующие ядро коллоида [AgI]m. Ядро адсорбирует на своей поверхности n ионов вещества, взятого в избытке, т. е. Ag+ или NО3 –. На твердой поверхности, согласно правилу Панета-Фаянса, адсорбируются прежде всего ионы, которые входят в состав ядра, т. е. ионы Ag+, придавая ядру положительный заряд + п. (В рассматриваемом случае ионы Ag+ образуют первый адсорбционный слой и называются потенциалопределяющими ионами.) Этот положительный (+ n) заряд притягивает к себе из раствора ионы NO3–, которые находятся ещё под действием теплового движения молекул растворителя, поэтому адсорбируется на ядре только их некоторая часть (n – x)NО3– т. е. на х меньше, чем ионов Ag+ в первом адсорбционном слое. Таким образом, твердая фаза оказывается с некоторым (x+) положительным зарядом. Ядро вместе с адсорбционными слоями носит название гранулы и при изображении выделяется фигурными скобками: {[AgI] m ∙ n Ag+ ∙ (n – x) NO3 – } x+ Оставшиеся ионы NO3 – неравномерно распределяются по дисперсной среде, образуя так называемый диффузный слой. Концентрация ионов в диффузном слое уменьшается от ядра коллоида к периферии. В формуле ионы NO3– диффузного слоя помещаются за фигурные скобки: {[AgI] m ∙ n Ag+ ∙ (n – x) NO3 – } x+ ∙ x NO3– . Гранула вместе с ионами диффузного слоя называется мицеллой. Между положительно заряженной (х+)гранулой и диффузным слоем возникает разность потенциалов, названная электрокинетическим потенциалом или дзета-потенциалом (ζ). (Электрокинетическим он назван потому, что связан с перемещением коллоидов в электрическом поле.) Разность потенциалов между зарядом ионов первого адсорбционного слоя и всех противоионов, находящихся в адсорбционном и диффузном слоях, называется термодинамическим потенциалом. В целом мицелла электронейтральна. Распределение зарядов и потенциала в мицелле {[AgI] m ∙ n Ag+ ∙ (n – x) NO3 – } x+ ∙ x NO3– показано на рисунке 1, где [AgI] – ядро, ЕК – поверхность ядра, АВ – граница между адсорбционным слоем толщиной КВ и диффузным слоем BD; ED – максимальное значение термодинамического потенциала в вольтах, ВС – величина электрокинетического потенциала (ζ), CD – уменьшение ζ-потенциала в диффузном слое. С удалением от ядра [AgI] он падает до нулевого значения.
Рис. 1. Распределение зарядов и потенциала в мицелле На рисунке 2 схематично изображено строение мицеллы иодида серебра, полученной при избытке AgNO3 (а) и KI (б). Если взять при получении коллоида AgI избыток KI, то можно получить коллоид с отрицательно заряженной гранулой. Тогда при том же ядре [AgI] в первом адсорбционном слое будет по-тенциалопределяющим ионом I – [AgI]m n I – , а во втором адсорбционном слое – противоионом – катион К+: {[AgI] m ∙ n I – ∙ (n – x) K + } x – Гранула приобретает отрицательный заряд. В диффузном слое противоионы К+: {[AgI] m ∙ n I – ∙ (n – x) K + } x – ∙ x K+.
Рис. 2. Схема строения мицеллы коллоидного раствора иодида серебра Рассмотрим еще один пример возникновения отрицательного заряда на грануле коллоида. При пропускании сероводорода через разбавленный раствор гидроксида сурьмы (III) возможно образование золя сульфида сурьмы Sb2S3: 2Sb(OH)3 + 3H2S = Sb2S3 + 6H2О. Один из ионов диссоциирующей сероводородной кислоты по уравнению nH2S <=> n H+ + nHS – придает заряд грануле. На ядре [Sb2S3]m по правилу Панета – Фаянса адсорбируется n ионов HS– , являясь потенциалопределяющими, а противоионами оказываются ионы водорода (п – х)Н+. Таким образом, гранула {[Sb2S3]m ∙ nHS– ∙ (n – x) H+} x – приобретает отрицательный заряд. В диффузном слое остается часть (х)ионов водорода Н+. Формула мицеллы имеет вид: {[Sb2S3]m ∙ nHS – ∙ (n – x) H+} x – ∙ x H+ Некоторые другие коллоиды сульфидов металлов As2S3‚CdS‚ PbS тоже имеют отрицательный заряд. Кроме того, отрицательный заряд могут иметь коллоиды: серы, кремниевой и оловянной кислот, мыла, крахмала, гумуса, гуммиарабика, почвенных частиц, белки в щелочной среде, основные красители, золи ТiO2‚А1(ОН)3‚ Cr(OH)3‚ Fe(OH)3 и другие вещества. Изоэлектрическое состояние. Гранула может и не иметь заряда. Такое состояние коллоидной системы называется изоэлектрическим. Дзета-потенциал в этом случае равен нулю. Значение дзета-потенциала зависит от количественного распределения противоионов между вторым адсорбционным слоем и диффузным слоем. Чем меньше противоионов в адсорбционном слое, тем больше дзета-потенциал и тем ближе становится он к значению термодинамического потенциала. Создавая условия перехода противоионов из диффузного слоя в адсорбционный, например увеличением концентрации в растворе ионов одного с противоионами знака, можно уменьшить дзета-потенциал до нулевого значения. Схематично уменьшение дзета-потенциала при переходе противоионов из диффузного слоя в адсорбционный показано на рисунке 3.
Ри. 3. Схема уменьшения дзета-потенциала до нуля: (+) – положительно заряженные потенциалопределяющие ионы; (–) - противоионы‚ АВ – граница твердой фазы (гранулы) с диффузным слоем. На рисунке 3 а показано ядро гранулы с первым адсорбционным слоем катионов (потенциалопределяющих), которых, предположим 20 (+), во втором адсорбционном слое противоионов 10 (–). Гранула имеет избыток положительных зарядов. Дзета-потенциал равен ζ1. При переходе 5 анионов из диффузного слоя в адсорбционный (рис. 3 б) часть положительных зарядов нейтрализуется 20 (+) и 15 (–). Заряд гранулы сохраняется, но становится меньшим по величине. Дзета-потенциал равен ζ2 (ζ1>ζ2). Положение на рисунке 3 в отражает изоэлектрическое состояние, так как число положительных зарядов первого адсорбционного слоя 20 (+) из-за ещё перешедших ионов (–) из диффузного слоя на поверхность гранулы стало равно числу зарядов второго адсорбционного слоя 20 (–). Гранула не заряжена, дзета-потенциал равен нулю ζ 3 = 0. Относительная устойчивость коллоидных растворов – это способность системы в течение определённого времени сохранять неизменной свою структуру‚ т. е. размеры частиц и их равномерное распределение в объёме системы. Выделяют седиментационную (кинетическую) и агрегативную относительную устойчивость дисперсных систем. Седиментационная устойчивость – это способность дисперсной системы сохранять неизменным во времени распределение частиц по объёму системы‚ т. е. способность системы противостоять действии силы тяжести. Агрегативная устойчивость – это способность дисперсной системы сохранять неизменной во времени степень дисперсности‚ т. е. размеры частиц и их индивидуальность. При нарушении агрегативной устойчивости происходит коагуляция. Коагуляция коллоидных растворов. Устойчивость золя можно нарушить, устранив одноименный заряд коллоидных частиц и защитную гидратную оболочку. На границе раздела коллоидная частица – среда устанавливаются два равновесия: Противоионы в коллоидной частице <=> Противоионы в среде (1) Вода в коллоидной частице <=> Вода в среде (2) Если сместить равновесие (1) влево, то возрастет число противоионов в коллоидной частице и уменьшится её заряд. Уменьшение заряда частицы приведет, в свою очередь, к уменьшению числа молекул воды в гидратной оболочке коллоидной частицы, т. е. к смещению равновесия (2) в правую сторону. Устойчивость коллоидной системы нарушится. При некоторых условиях число противоионов в коллоидной частице может стать таким; что их заряд полностью нейтрализует заряд зарядообразующих ионов, т. е. коллоидная частица станет незаряженной. Такое состояние коллоидной частицы называется изоэлектрическим. Гидратная оболочка частицы в изоэлектрическом состоянии в значительной мере разрушена. Коллоидные частицы не защищены и при столкновениях слипаются, укрупняются. Процесс слипания частиц с образованием крупных агрегатов называется коагуляцией. Коагуляция золя приводит к потере его кинетической (седиментационной) устойчивости (частицы становятся слишком крупными и не могут участвовать в броуновском движении), которая выражается в образовании осадка. Правила коагуляции: 1. Все сильные электролиты‚ добавленные к золю в достаточном количестве‚ вызывают его коагуляцию. 2. Коагулирующим действием обладает не весь электролит‚ а только тот ион‚ заряд которого совпадает по знаку с зарядом противоиона мицеллы лиофобного золя. Этот ион называют ионом-коагулянтом. 3. Коагулирующая способность иона-коагулянта тем больше‚ чем больше заряд иона – правило Шульце-Гарди. Одним из основных методов коагуляции служит введение в коллоидную систему электролита, имеющего противоионы по отношению к заряженным коллоидным частицам. Например, в растворе с отрицательно заряженными коллоидными частицами вводят сульфаты алюминия или железа (II). В результате заряд коллоидных частиц нейтрализуется. Кроме того‚ при этом происходит гидратация ионов электролита за счет молекул Н2О из дисперсионной среды. Результатом является нарушение устойчивости золя, сопровождающееся его коагуляцией. Коагуляцию также проводят путем анодного растворения алюминия и железа с переходом в раствор ионов Al3+ и Fe2+. Лиофильные системы. К лиофильным системам относятся коллоидные поверхностно-активные вещества (ПАВ) и растворы высокомолекулярных соединений (ВМС). Коллоидные ПАВ – это вещества‚ которые не только снижают поверхностное натяжение на границе раздела фаз‚ но и при определённых концентрациях способны к самопроизвольному мицеллообразованию‚ т. е. к образованию новой фазы. Самопроизвольно образующиеся мицеллы (мицеллы Гартли) – это ассоциат дифильных молекул‚ лиофильные группы которых обращены к растворителю‚ а лиофобные группы соединяются друг с другом‚ образуя ядро (рис. 4).
Высокомолекулярные соединения – это вещества‚ имеющие молекулярную массу от 10000 до нескольких миллионов а. е. м. По происхождению ВМС делятся на натуральные (белки‚ шерсть‚ шёлк‚ полисахариды) и синтетические (получаемые в результате химического синтеза из низкомолекулярных ненасыщенных или полифункциональных соединений – мономеров – в результате реакций полимеризации‚ поликонденсации и сополимеризации); по строению полимерной цепи ВМС бывают: линейными (полиэтилен)‚ разветвлёнными (крахмал) и пространственными (фенолформальдегидные смолы).
Задачи для самостоятельного решения 130. Напишите уравнения реакций, при помощи которых можно получить гидрозоли веществ: AgI, Sb2S3, Fe(OH)3. Напишите формулы мицелл. 131. Напишите уравнение реакции, показывающее получение золя бромида серебра при взаимодействии раствора нитрата серебра с избытком бромида калия. Напишите формулу мицеллы. 132. Напишите уравнение реакции, показывающее получение золя хлорида серебра при взаимодействии избытка нитрата серебра с раствором хлорида натрия. Напишите формулу мицеллы. 133. Напишите формулу мицеллы сульфата бария, полученной при взаимодействии разбавленного раствора хлорида бария с избытком разбавленного раствора серной кислоты. 134. Определите заряд коллоидной частицы, которая образуется при взаимодействии избытка раствора хлорида бария с серной кислотой. Напишите формулу мицеллы. 135. Какой ион определяет потенциал коллоидной частицы, полученной при взаимодействии нитрата серебра с избытком иодида калия? 136. Определите направление движения в электрическом поле коллоидной частицы иодида серебра, полученной при взаимодействии раствора нитрата серебра с избытком иодида калия. Напишите формулу мицеллы. 137. Определите‚ к какому электроду при электрофорезе будет двигаться коллоидная частица гидроксида железа (III), полученная при взаимодействии раствора хлорида железа (III) с избытком гидроксида натрия. Напишите формулу мицеллы.
|