Множества
Цифры в последней колонке таблицы отвечают индексам кислорода в оксидах азота, если учитывать димеры. Следовательно, для каждого элемента есть наименьшее массовое количество его, что может сообщаться с другим элементом и ее называют атомом. Закон эквивалентов. Закон эквивалентов является логическим продолжением закономерностей, что описывает закон кратных отношений, и сформулирован он был также в 1803 году Дж.Дальтоном: " Элементы сообщаются друг с другом, а индивидуальные вещества взаимодействуют между собой в весовых количествах, прямо пропорциональных их эквивалентам ". Атомно-молекулярное учение дало также четкое определение валентности элемента: " Валентность элемента - это способность его атомов присоединять определенное число атомов другого элемента". За единицу измерения валентности принято валентность атома водорода (одновалентный). Пользуясь понятиям моль как единицы количества вещества, можно таким образом дать определение химического эквивалента вещества: " Весовые количества элементов, которые соединяются (условно отвечают) с одним весовым количеством (одним молем атомов) водорода (точнее 1,008 г) или с соответствующими ему весовыми количествами других элементов, называют эквивалентами (моль-эквивалентами или частями соединения). Эквивалент можно рассчитывать не только для отдельных элементов, но и для химических соединений. В последнем случае эквивалентом соединения будет такое его количество, которое соединяется, замещает или отвечает в химической реакции одной весовой части водорода, восьми весовым частям кислорода или эквивалента любого элемента. Для отдельного элемента эквивалент рассчитывается как часть от деления атомной массы на его возможную валентность в соединении. Например, в соединении MnO2 валентность марганца 4, а следовательно его эквивалент будет ровным: Э(Mn) = Mr(Mn): 4 = 54,94: 4 = 13,73. На практике для кислот эквивалент находят как часть молекулярной массы, которая приходится на ее основность в данной реакции (количество замещенных атомов водорода). Например, для реакции H 3 PO 4 + 2NH 3 = (NH 4) 2 HPO 4 эквивалент фосфорной кислоты будет равняться: Э = Mr (H 3 PO 4):2 = 98: 2 = 49. Аналогично поступают в случае реакций с основаниями, учитывая количество замещенных гидроксильных групп (ОН). Например, для гидроксида алюминия в реакции Al(OH) 3 + 2HCl = Al(OH)Cl 2 + 2H 2 O его эквивалент будет равен: Э = Mr(Al(OH) 3):2 = 77,98: 2 = 38,99. В случае расчета эквивалента солей его можно определять как частное от деления молекулярной массы соли на произведение количества атомов металла в молекуле на его валентность (количество химических связей). Например, для Al2(SO4)3 эквивалент соли будет равняться: Законы газового состояния. Количественные расчеты реагентов, которые находятся в газообразном состоянии, удобнее выполнять не за массой, а за их объемом. В основу таких расчетов положены законы Гей-Люссака и Авогадро. Закон объемных соотношений. Закон сформулирован в 1808 году Ж.Гей-Люссаком: " При одинаковых условиях объемы газов, которые вступают в реакцию, относятся между собой и к объемам полученных газов как простые целые числа";. Да, в реакции горения этана в кислороде 2C 2 H 6 + 7O 2 = 4CO 2 + 6H 2 O соотношение объемов газов такое: V(C2H6): V(O2): V(CO2): V(H2O) = 2: 7: 4: 6. А.Авогадро объяснил данный закон тем, что газы состоят не из атомов, а из молекул, а молекулы простых газов - из двух атомов, например H2, O2. Закон Авогадро. Закон сформулирован в 1811 году так: " В одинаковых объемах различных газов, взятых при одинаковом давлении и одинаковой температуре, содержится одинаковое количество молекул ". Закону Авогадро подлежат лишь газы и с позиций атомно-молеку-лярного учения это объясняется следующим: 1) объем, что занимает некоторое количество вещества определяется числом структурных частиц (молекул, атомов и тому подобное), их размерами и расстояниями между ними; 2) в газах при условиях низкого давления расстояния между молекулами приблизительно в тысячу раз превышают размеры самих молекул, то есть ими можно пренебречь в расчетах; 3) вследствие этого объем газа можно определять, исходя из числа молекул и средних расстояний между ними; 4) при одинаковых условиях (давление и температура) расстояния между молекулами в разных газах одинаковые. Поэтому при одинаковых условиях равные объемы разных газов содержат одно и то же число молекул и наоборот. На основе закона Авогадро как его следствия были определены и сформулированы понятия о молярном объеме газа, относительные плотности газов и молекулярные массы, постоянная Авогадро и универсальная газовая постоянная (константа). Следствия закона Авогадро. По отношению к самому легкому газу водороду, молярная масса которого приблизительно 2 г/моль, имеем: " Молекулярная масса вещества в газообразном состоянии равняется его удвоенной плотности по водороду ". При этом под плотностью вещества понимают физическую величину, что определяется отношением массы вещества к соответствующему ее объему: с=m: V.
6. РАСПРОСТРАНЕНИЕ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ В ПРИРОДЕ Геохимические исследования состава минералов нашей планеты Земля дали возможность определить относительное содержимое химических элементов в земной коре, что измеряется в кларках. Кларком называют количество определенного элемента в системе, что выражается в процентах (массовый или атомный кларк). Массовые кларки были определены в конце XIX - в начале XX ст. Д.Кларком, В.Гольдшмідтом и А.Ферсманом, а в 1962 году наиболее точные расчеты выполнил А.П.Виноградов (табл. 2). Самым распространенным элементом на Земле является кислород, восемь элементов (O, Si, Al, Fe, Ca, Na, K, Mg) составляют 98,53% общей массы земной коры, а на остальные элементы приходится лишь 1,47%
Таблица 2. Атомные и массовые кларки некоторых элементов
Все химические элементы условно разделяют на 3 основные группы: - распространеные (O, Si, Al, Fe, Ca, Na, K, Mg, H, C, Zn, Cu, Mn, Cl, N, P, S, F, Ba, Sr, Cr), общее содержимое которых представляет 99,15% массы земной коры; - редкие (Li, Rb, La, U, Re) - это мало распространенные в природе, но образуют минералы или месторождения. Их кларк колеблется от 10-2 до 10-8 % масс. К редким принадлежат также рассеянные элементы. - рассеянные (In, Hf, Te) - это элементы, содержимое которых в земной коре незначительно (10-4-10-7% масс.), они не образуют месторождений, а случаются как примеси к другим элементам.
В природе химические элементы встречаются в разном агрегатном состоянии: - э лементном состоянии (благородные или инертные газы He, Ar, Kr; платиновые и благородные металлы Pt, Pd, Au, Ag; аллотропные видоизменения углерода как алмаз, графит и тому подобное); - в связанном состоянии в виде: - оксидов (H, C, Fe, Si, Mn, Al, U, Ti, Sn, Cu,) - гидроксидов (Fe, Al, Mn, Mg, B) - сульфидов (Zn, Cd, Hg, Cu, Co, Ni, Pb, Ag, Hg, Fe, Sb, Bi, As, Mo) - галогенидов (K, Na, Li, NH 4, Ag, Mg, Ca) - карбонатов (Ca, Mg, Sr, Fe, Mn, Ba, Pb, Zn) - сульфатов (Ba, Mg, Ca, Na, Pb) - нитратов (Na, K) - силикатов (Al, Mg, Ca, Fe, Mn, Cr, Cu, Pb, Na) - фосфатов (Y, Ce, Ca, Pb, Al, Fe, UO 22+) и т.д.
7. КОНТРОЛЬНЫЕ ВОПРОСЫ. 1. Назовите агрегатные состояния H2O, что находится в виде воды, пара и льда. Какие процессы происходят во время этих переходов? 1. При нагревании серы она сначала плавится, а потом горит. Чем отличаются эти процессы? 2. Какие признаки химической формы движения материи? 3. Какая частица первична - атом или молекула? Ответ мотивируйте. 4. Какими единицами принято измерять атомную и молекулярную массу, количество вещества? 5. Как взаимосвязанные количество вещества и его молярная масса? 6. Почему для химических процессов верный отдельный случай закона сохранения материи - закон сохранения массы? 7. На примере реакции горения фосфора покажите действенность закону сохранения массы веществ. 8. Наведите уравнение трех реакций получения SO2, которые подтверждают закон постоянства состава веществ. 9. На примере оксидов MnO, MnO2, Mn2O7 покажите действенность закону кратных отношений. 10. Почему молярная масса элемента постоянная величина, а его эквивалентная масса переменная (может изменяться)? 11. В каких случаях значения эквивалента серной кислоты будет наименьшим во время ее превращения: а) на кислую соль; б) на среднюю соль; в) на диоксид серы; г) на свободную серу; д) на сероводород? 12. Зависит ли число частей, из которых состоит один моль вещества, от его агрегатного состояния? 13. Как проще всего найти ответ на вопрос: в сколько раз один газ легче или тяжелее другого? 14. Будут ли одинаковое количество молекул содержать 11,2 л азота и водорода, 28 г азота и 1 г водорода, 5,6 л кислорода и 71 г хлора? Доведите расчетами. Множества Множества будем обозначать заглавными буквами латинского алфавита A, B, C, …, а их элементы – строчными a, b, c,… Запись x Î A означает, что элемент x принадлежит множеству A, а запись А Ì В означает, что множество А содержится в множестве В, т.е. x Î A Þ x Î В. В последнем случае говорят, что А есть подмножество множества В. Объединение множеств А и В обозначается А È В. Оно состоит из всех элементов, принадлежащих А или В. Пересечение множеств А и В обозначается А Ç В. Оно состоит из всех элементов, принадлежащих как А, так и В.
Через Æ обозначается пустое множество, не содержащее ни одного элемента.
Напомним, что: 1, 2, 3, 4, …– натуральные числа; … – 2, – 1, 0, 1, 2,…– целые числа. Числа вида
|

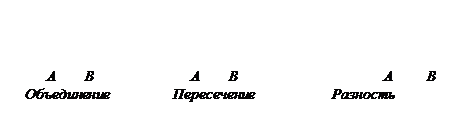



















 Разность множеств А и В обозначается А \ В. Она состоит из всех элементов, принадлежащих А, но не принадлежащих В.
Разность множеств А и В обозначается А \ В. Она состоит из всех элементов, принадлежащих А, но не принадлежащих В.

 2. Числовая ось
2. Числовая ось


 Числовая ось – прямая, на которой указано положительное направление, начало 0 и единица 1 (масштаб). Каждой точке оси соответствует вещественное число.
Числовая ось – прямая, на которой указано положительное направление, начало 0 и единица 1 (масштаб). Каждой точке оси соответствует вещественное число.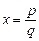 , где p и q – целые, называются рациональными. Остальные вещественные числа – иррациональные, например
, где p и q – целые, называются рациональными. Остальные вещественные числа – иррациональные, например 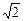 . Они представляются в виде бесконечных непериодических десятичных дробей.
. Они представляются в виде бесконечных непериодических десятичных дробей.


