Окислительно-восстановительные потенциалы и направление протекания окислительно-восстановительных реакцийКак следует из вышеизложенного материала уравнение любой окислительно-восстановительной реакции можно составить из двух ионно-электронных уравнений, одно из которых описывает процесс окисления восстановителя, а другое – процесс восстановления окислителя. В теории окислительно-восстановительных реакций систему (т.е. совокупность реагирующих веществ), в которой принимает участие окислитель, называют окислительной системой. Система, в которой участвует восстановитель, называется восстановительной системой. Например, в реакции Zn + CuSO4 ® ZnSO4 + Cu Zn + Cu2+ ® Zn2+ + Cu
восстановитель окислитель
окислительная система: Cu2+ + 2e– ® Cu
Каждую такую систему можно охарактеризовать величиной окислительно-восстановительного потенциала (часто этот потенциал также называют электродным потенциалом). В общем случае для электродного потенциала системы Ox + ne– ⇆ Red (где Ox – окисленная форма, т.е. вещество, принимающее электроны, а Red – восстановленная форма, в которую превращается окисленная форма после присоединения электронов) принято следующее обозначение: Обозначение потенциала окислительно-восстановительной системы, как и численное значение потенциала не зависит от того, как записано равновесие: и для записи Zn2+ + 2e– ⇆ Zn, и для записи Zn ⇆ Zn2+ + 2e– обозначение потенциала одно и то же: то же состояние равновесия. Численное значение электродного потенциала зависит от концентрации веществ в растворе, температуры раствора, а если в процессе участвует газообразное вещество, то и давления. Поэтому для сопоставления электродных потенциалов различных процессов значения потенциалов обычно приводят к стандартным условиям: концентрация участников реакции в растворе – 1 моль/л, температура – 25°C (298 K), давление – 1 атмосфера. Электродные потенциалы, характеризующие окислительно-восстановительную систему в стандартных условиях, называются стандартными электродными потенциалами и обозначаются E°, например,
В любой окислительно-восстановительной реакции система с бо́льшим значением электродного потенциала является окислительной системой, а система с меньшим значением электродного потенциала – восстановительной системой.
восстановительная система: Zn ® Zn2+ + 2e– окислительная система: Cu2+ + 2e– ® Cu
Это правило можно сформулировать и иначе: окислительно-восстановительная реакция может протекать в прямом направлениилишь в том случае, если электродный потенциал окислительной системы больше потенциала восстановительной системы.
Стандартный электродный потенциал – это справочная величина; её можно найти во многих химических справочниках, например, [3; 4].
Пример 4.5. Используя величины стандартных электродных потенциалов, объясните, можно ли выделить серебро, действуя на раствора нитрата серебра металлической медью? Записываем предполагаемое уравнение реакции:
Cu + 2AgNO3 ® Cu(NO3)2 + 2Ag
Восстановитель в этой реакции – металлическая медь (Cu0), окислитель – атомы Ag+1 (точнее говоря, ионы Ag+). восстановительная система: Cu ® Cu2+ + 2e– окислительная система: Ag+ + e– ® Ag Так как потенциал окислительной системы больше потенциала восстановительной системы, реакция возможна и серебро может быть вытеснено медью из водного раствора AgNO3.
Пример 4.6. Используя величины стандартных электродных потенциалов, объясните, можно ли металлическую ртуть растворить в разбавленной азотной кислоте, восстановив HNO3 до NO? Предполагаемое уравнение реакции:
3Hg + 8HNO3 ® 3Hg(NO3)2 + 2NO + 4H2O
Восстановитель в этой реакции – металлическая ртуть (Hg0), окислитель – атомы N+5 в составе нитрат-ионов:
восстановительная система: Hg ® Hg2+ + 2e– окислительная система: NO3– + 4H+ +3e– ®NO + 2H2O Так как потенциал окислительной системы больше потенциала восстановительной системы, реакция будет протекать.
Пример 4.7. Поваренную соль часто иодируют (добавляют йод для профилактики заболеваний щитовидной железы). Используя величины стандартных электродных потенциалов, объясните, не будет ли происходить взаимодействие йода с водным раствором хлорида натрия, сопровождающееся выделением хлора. Докажем невозможность этой гипотетической реакции
сравнив потенциалы окислительной и восстановительной систем. Для того чтобы такая реакция могла протекать, йод должен был бы выступить в роли окислителя, а атом хлора Cl–1 (т.е. ион Cl–) в роли восстановителя: восстановительная система: 2Cl– ® Cl2 + 2e– окислительная система: I2 + 2e– ® 2I– Потенциал предполагаемой окислительной системы намного меньше потенциала системы, которая в этой реакции должна была бы быть восстановительной системой. Следовательно, йод не реагирует с раствором хлорида натрия.
Пример 4.8. Почему амфотерные металлы, например, цинк реагируют с растворами щелочей, вытесняя из воды водород? Ответ обоснуйте, используя величины стандартных электродных потенциалов.
Любой металл в виде простого вещества – восстановитель (у металлов низшая степень окисления равна нулю). Амфотерные металлы, например, цинк в водных растворах щелочей, окисляясь, превращаются в гидроксокомплексы (см. также раздел 4.3). Окислителем в этой реакции являются атомы H+1 (высшая степень окисления) в молекулах воды:
Zn + 2NaOH + 2HOH ® Na2[Zn(OH)4] + H2
восстановительная система: Zn+4OH– ® [Zn(OH)4]2–+2e–
окислительная система: 2HOH + 2e– ® H2 + 2OH–
Так как потенциал окислительной системы больше потенциала восстановительной системы, реакция возможна, и цинк будет реагировать с раствором щелочи, вытесняя из воды водород.
|


 . Например, потенциал системы Cu2+ + 2e– ⇆ Cu обозначается
. Например, потенциал системы Cu2+ + 2e– ⇆ Cu обозначается  .
. , поскольку обе эти записи выражают одно и
, поскольку обе эти записи выражают одно и .
. = –0,76 В;
= –0,76 В;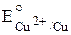 = +0,34 В.
= +0,34 В. = +0,80 В.
= +0,80 В. = +0,85 В,
= +0,85 В, = +0,96 В.
= +0,96 В.
 I2 + 2NaCl Cl2 + 2NaI
I2 + 2NaCl Cl2 + 2NaI
 = +1,35 В;
= +1,35 В; = +0,34 В.
= +0,34 В. = –1,22 В
= –1,22 В = – 0,83 В
= – 0,83 В


