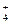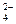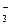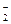Деление анионов на группы основано на их отношении к различным реактивам; к растворам солей бария, стронция, кальция, магния, серебра, свинца и др., а также к кислотам, окислителям, восстановителям. С этими реактивами анионы образуют малорастворимые осадки, газообразные вещества и характерные окрашенные соединения. Общепринятой аналитической классификации анионов не существует.
Реактивы, дающие возможность определять принадлежность исследуемых анионов к определенной аналитической группе и отделять одну группу от другой, по своему характеру действия можно классифицировать следующим образом.
Групповые реактивы, осаждающие определенные анионы в виде малорастворимых соединений: растворимые соли бария, нитрат серебра, растворимые соли свинца, магнезиальная смесь.
Групповые реактивы, окисляющие анионы-восстановители: перманганат калия.
Групповые реактивы, восстанавливающие анионы-окислители: йодистоводородная кислота или йодистый калий.
Групповые реактивы, позволяющие проводить пробы на анионы летучих кислот: разбавленная соляная кислота.
Групповые реактивы, разлагающие анионы и их соли с образованием более простых продуктов реакций: концентрированная серная кислота.
Существующие методы анализа анионов можно разделить на три основные группы.
1. Систематические методы, основанные, подобно классическому сероводородному методу анализа катионов, на деление анионов на группы, осаждаемые последовательно определенными групповыми реактивами. При этом анализ ведется из одной порции раствора.
Систематические методы анализа анионов применяют для исследования несложных смесей. Для систематического анализа более сложных смесей анионов число последовательно проводимых операций сильно возрастает. В связи с этим возрастает степень загрязненности анализируемого раствора посторонними примесями за счет добавления все новых реактивов. Вследствие этого обнаружение анионов к концу анализа становится весьма затруднительно.
2. Дробные методы анализа, основанные на открытии анионов из отдельных порций исследуемого раствора, успешно применяют для анализа смесей, не содержащих мешающих друг другу анионов. Более сложные смеси вызывают необходимость предварительного их разделения на отдельные группы.
3. Полусистематические методы анализа основаны на делении анионов по группам, но анализ исследуемого раствора проводят не из одной, а из нескольких порций.
Полусистематические методы дают возможность использовать преимущества систематических и дробных методов анализа. Отделение одних групп анионов от других при помощи групповых реактивов дает возможность отделить мешающие друг другу анионы, а использование дробного метода позволяет сократить число последовательных аналитических операций. В этом случае групповые реактивы используются не только для разделения анионов, но и для обнаружения данной группы анионов.
Таблица 11 - Действие некоторых реактивов на анионы первой аналитической группы
| Реактивы
| Анионы
|
| SO32–
| SO42–
| CO32–
|
| BaCl2
| BaSO3 (белый осадок, растворимый в кислотах)
| BaSO4 (белый осадок, не растворимый в кислотах)
| BaCO3 (белый осадок, растворимый в кислотах)
|
| H2SO4 разб.
| SO2
| –
| CO2
|
| H2SO4 конц.
| SO2
| SO2
| CO2
|
| KMnO4 в присутствии раствора H2SO4
| SO42– (окраска перманганат-иона исчезает)
| –
| –
|
| AgNO3
| Ag2SO3 (белый осадок, растворяется в кислотах)
| Ag2SO4 (белый осадок, заметно растворяется в воде)
| Ag2CO3 (белый осадок, растворяется в кислотах)
|
| Реактивы
| S2O32–
| PO43–
| C2O42–
|
| BaCl2
| BaS2O3 (белый осадок из конц. растворов)
| Ba3 (PO4)2 (белый осадок, растворяется в кислотах)
| BaC2O4 (белый осадок, растворяется в кислотах)
|
| H2SO4 конц.
| SO2
| H3PO4
| CO, CO2
|
| H2SO4 разб.
| SO2 + S
| –
| HC2O4–
|
| MgCl2 + NH4OH +
NH4Cl
|
|
| MgC2O4 (осадок выпадает из конц. растворов, растворяется в минеральных кислотах)
|
Таблица 12 - Действие некоторых реактивов на анионы второй аналитической группы
| Реактивы
| Cl-
| S2–
|
| ВaCl2
| Осадок не образуется
| Осадок не образуется
|
| AgNO3
| AgCl Образуется белый творожистый осадок, который растворяется в растворах аммиака и в Na2S2O3
| Ag2S (черный осадок, растворимый в HNO3)
|
| HCl
| –
| H2S (газ с характерным запахом)
|
| H2SO4 конц.
| HCl
| H2S, SO2 (газы с характерным запахом)
|
Таблица 13 - Действие некоторых реактивов на анионы третьей аналитической группы
| Реактив
| NO2-
| NO3-
|
| BaCl2
| Осадок не образуется
| Осадок не образуется
|
| AgNO3
| Осадок не образуется
| Осадок не образуется
|
| H2SO4 конц.
| NO + NO2
| NO2
|
| FeSO4
(кислая среда)
| [Fe(NO)]SO4
pH = 3–4, наблюдается бурое окрашивание раствора
| [Fe(NO)]SO4
В среде концентрированной серной кислоты наблюдается бурое окрашивание раствора
|
| KМnO4
(кислая среда)
| NO3– при температуре 50–60 °С наблюдается обесцвечивание раствора
| –
|
При выполнении лабораторной работы следует соблюдать последовательность опытов, указанных в табл. 12, 13. В отчете уравнения проведенных реакций записываются в ионной и молекулярной формах.
Контрольная работа № II
Анализ индивидуальных соединений
Цель работы: применяя экспериментальные навыки и знания по систематическому анализу катионов и анионов, выполнить анализ контрольных образцов минеральных солей.
Качественный анализ индивидуального вещества выполняют в две стадии. На первой стадии проводят предварительные испытания, а на второй – переходят к систематическому анализу катионов и анионов, используя методики анализа смеси катионов и анионов.
Предварительные испытания позволяют установить присутствие некоторых элементов, обнаружение которых затруднено при систематическом анализе.
К предварительным испытаниям относят окрашивание пламени летучими соединениями некоторых элементов. Растворимость образца в воде. В табл. 9 приведены предварительные испытания на катионы. После предварительных испытаний проводят систематический анализ. Ход анализа зависит от принятой классификации катионов и анионов. В данном методическом руководстве предлагается принять кислотно-основную классификацию катионов. Порцию образца соли растворяют в воде и, с помощью групповых реагентов, определяют аналитическую группу катиона и аниона.
Затем открывают катион и анион в образце, выполняя соответствующие качественные реакции. В табл. 1 приведены аналитические группы катионов по кислотно-основной классификации. В табл. 15 указаны проверочные реакции на катионы и анионы, которые можно применить в анализе.
Таблица 14 - Предварительные испытания на катионы
| Катион
| Химическая реакция
| Аналитический эффект
|
NH 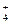
| К нескольким каплям раствора соли (к нескольким кристалликам сухой соли) прибавляют 0.5 мл 2н. раствора NaOH, смесь нагревают (1).
К нескольким каплям полученного раствора (1) добавляют 3–5 капель реактива Несслера
| Выделение газа с характерным запахом
Раствор окрашивается в желто-бурый цвет
|
| Fe2+
| К нескольким каплям анализируемого раствора прибавляют 2–3 капли 2н. HCl и 1 каплю раствора K3[Fe(CN)6]
| Выпадает темно-синий осадок турнбулевой сини
|
| Fe3+
| К нескольким каплям прибавляют 1-2 капли 2Н HCl и 1 каплю раствора K4[Fe(CN)6]
| Выпадает синий осадок берлинской лазури
|
| Cr3+
| К 0.5 мл анализируемого раствора прибавляют 0.2 мл 0.1 н. раствора KMnO4 и 1–2мл 2Н раствора H2SO4, нагревают и прибавляют 0.5 мл 3% раствора Н2О2
| Раствор окрашивается в зеленый цвет (в присутствии эфира эфирный слой окрашивается в синий цвет)
|
| Mn2+
| К раствору анализируемого вещества прибавляют несколько капель 2н. раствора HNO3, добавляют 0.5 мл Н2О2 и нагревают.
| Раствор окрашивается в красно-фиолетовый цвет
|
Таблица 15 - Проверочные реакции на катионы
| №реакции
| Катионы
| Выполнение реакции
| Аналитический эффект
|
|
| Pb2+
| 1 каплю анализируемого раствора помещают на фильтровальную бумагу и обрабатывают 1 каплей раствора родизоната натрия
| Появляется синее пятно или кольцо, которое при прибавлении буферного раствора с рН 2.8 окрашивается в красный цвет
|
|
| Ag+
| К 5 каплям анализируемого раствора прибавляют одну каплю 5%-ного раствора KJ
| Выпадает бледно-желтый осадок иодида серебра, нерастворимый в аммиаке
|
|
| Bi3+
| К 5 каплям раствора прибавляют по каплям 2н. раствора NaOH до появления осадка и 3–5 капель свежеприготовленного раствора станнита натрия
| Выпадает черный осадок металлического висмута
|
|
| Cu2+
| К 5 каплям раствора прибавляют 2–3 капли раствора K4[Fe(CN)6]
| Выпадает красный осадок гексацианоферрата меди
|
|
| Cd2+
| К 5 каплям раствора прибавляют 2–3 капли 2н. раствора HCl и 5 капель свежеприготовленной сероводородной воды
| Выпадает осадок сульфида кадмия канареечно-желтого цвета
|
|
| Sn2+
| К 2–3 каплям раствора прибавляют 1–2 капли 2%-ного раствора Hg(NO3)2
| Выпадает белый осадок каломели, чернеющей вследствие ее восстановления до металлической ртути
|
|
| Ni2+
| На фильтровальную бумагу помещают 1 каплю анализируемого раствора. После впитывания пятно смачивают 1 каплей спиртового раствора диметилглиоксима и обрабатывают в течение нескольких минут парами NH4OH
| Пятно окрашивается в красный цвет (реакция Л. А. Чугаева)
|
|
| Co2+
| К 2–3 каплям раствора прибавляют 2–3 капли 2Н раствора CH3COOH и 5 капель 7%-ного раствора KNO2. Раствор нагревают до кипения и охлаждают при перемешивании, потирая стенки пробирки стеклянной палочкой
| Выпадает желтый кристаллический осадок гексанитрокобальта-та калия-натрия
|
|
| Co2+
| К 2 каплям раствора прибавляют при перемешивании 5 капель насыщенного раствора NH4SCN в ацетоне
| В зависимости от содержания кобальта раствор окрашивается в синий или зеленый цвет
|
|
| Fe3+
| К 5 каплям раствора прибавляют 3–5 капель 5%-ного раствора сульфосалициловой кислоты
| Раствор окрашивается в розовый цвет
|
|
| Cr3+
| К 2-3 каплям раствора прибавляют 1мл 2н. раствора H2SO4, 1мл эфира 2–5 капель 3%-ного раствора H2O2
| Слой эфира окрашивается в синий цвет. Окраска неустойчива
|
|
| Mn2+
| К 3-5 каплям раствора прибаляют 3 капли 1н. раствора NaOH, 3–5 капель 3%-ного раствора H2O2
| Белый осадок гидроксида марганца чернеет от перекиси водорода
|
|
| Al3+
| К 3–5 каплям раствора прибавляют 0.5 мл ацетатного буфера с рН 5 и 1 мл раствора 8-оксихинолина
| Выпадает зеленовато-желтый кристаллический осадок 8-оксихинолята алюминия
|
|
| Zn2+
| К 3–5 каплям раствора прибавляют 1мл 2н. раствора СН3СООН пропускают H2S до насыщения
| Выпадает белый осадок сульфида цинка
|
|
| Ba2+
| К 2–3 каплям раствора прибавляют 3 капли 2н. раствора CH3COONa и 2–3 капли 2Н раствора K2Cr2O7
| Выпадает желтый кристаллический осадок хромата бария
|
|
| Sr2+
| На фильтровальную бумагу наносят 1 каплю раствора и смачивают пятно каплей раствора родизоната калия
| Появляется буровато-красное пятно, обесцвечивающееся при действии 2Н раствора HCl
|
|
| Ca2+
| К 2–3 каплям раствора прибавляют 5 капель 0.1н. раствора H2C2O4, по каплям 2н. раствора NH4OH до четкого запаха аммиака и нагревают до кипения
| Выпадает белый кристаллический осадок оксалата кальция, растворимый в минеральных кислотах
|
|
| Ca2+
| На фильтровальную бумагу помещают 1 каплю раствора. Пятно смачивают 1 каплей раствора родизоната натрия и 1 каплей 0.5н. раствора NaOH
| Пятно окрашивается в фиолетовый цвет
|
|
| Mg2+
| К 1–2 капли раствора прибавляют 2 капли 2н. раствора HCl и 2 капли 1Н раствора Na2HPO4. Затем при перемешивании прибавляют по каплям 2н. раствора NH4OH до четкого запаха. Во время перемешивания для ускорения выпадения осадка необходимо тереть стеклянной палочкой о стенки пробирки. кислотах
| Выпадает белый кристаллический осадок фосфата магния-аммония, растворимый в минеральных кислотах
|
|
| К+
| К 1 капле раствора прибавляют 1 каплю 2Н раствора ацетата натрия и 1–2 капли раствора Na3[Co(NO2)6]; раствор перемешивают, потирая палочкой о стенки пробирки
| Выпадает желтый кристаллический осадок гексанитрокобальтата натрия-калия
|
|
| Na+
| 3 капли раствора нейтрализуют 0.5%-ным раствором КОН до рН 7. Затем прибавляют 2–3 капли раствора K[Sb(OH)6] и перемешивают несколько минут, потирая стенки пробирки стеклянной палочкой
| Выпадает белый кристаллический осадок гексагидроксостибата натрия, растворимый в щелочах
|
Таблица 19 - Проверочные реакции анионов
| №
реакции
| Анион
| Выполнение реакции
| Аналитический эффект
|
|
| SO 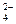
| На фильтровальную бумагу наносится 1 каплю 2н. раствора BaCl2 и каплю раствора родизоната натрия. Образовавшееся пятно смачивают 1 каплей анализируемого раствора
| Красное пятно обесцвечивается
|
|
| SO 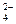
| К 1–2 каплям анализируемого раствора прибавляют 3–4 капли 6н. раствора НСl и 1–2 капли 2н. раствора BaCl2
| Выпадает белый кристаллический осадок сульфата бария, нерастворимого в кислотах и щелочах
|
|
| SO 
| К 5 каплям раствора прибавляют 2 капли 2н. раствора BaCl2
| Выпадает белый кристаллический осадок сульфита бария, хорошо растворимый в кислотах
|
|
| SO 
| К 5 каплям раствора прибавляют 1–2 капли раствора иода (5%-ного)
| Раствор йода обесцвечивается
|
|
| СО 
| К 5 каплям раствора прибавляют 2 капли 2Н раствора BaCl2
| Выпадает белый кристаллический осадок карбоната бария, хорошо растворимый в кислотах
|
|
| PO 
| 5 капель анализируемого раствора помещают в маленький тигель, туда же прибавляют 2 капли конц. азотной кислоты и смесь выпаривают досуха. К остатку прибавляют 2 капли конц. HNO3, 0.1 г кристаллического NH4NO3, 10 капель молибденовой жидкости и нагревают до 40–50 °С
| Выпадает желтый кристаллический осадок фосфоромолибдата аммония, легко растворимый в аммиаке
|
|
| Cl–
| К 5 каплям раствора прибавляют 3 капли 6н. раствора азотной кислоты и 3 капли раствора AgNO3
| Выпадает белый творожистый осадок, растворимый в аммиаке и тиосульфате натрия
|
|
| Br–
| К 5 каплям раствора прибавляют 3–5 капель свежеприготовленной хлорной воды и 0.5 мл бензола. Содержимое пробирки хорошо встряхивают и дают отстояться водному слою
| Слой бензола окрашивается бромом в красно-бурый цвет
|
|
| J–
| К 5 каплям раствора прибавляют 3–5 капель свежеприготовленной хлорной воды и 0.5 мл бензола. Хорошо встряхивают и дают водному слою отстояться
| Слой бензола окрашивается йодом в фиолетовый цвет
|
|
| S2–
| К 5 каплям раствора прибавляют 5 капель 5%-ного раствора CdCl2 и 1–2 капли 2н. раствора HCl
| Выпадает осадок сульфида кадмия канареечно-желтого цвета
|
|
| NO 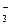
| 2–3 капли раствора помещают на часовое стекло. В раствор опускают кристаллик FeSO4 и добавляют 1 каплю конц. H2SO4
| На границе раздела жидкостей появляется бурое кольцо, хорошо видимое на белом фоне
|
|
| NO 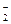
| 2–3 капли анализируемого раствора помещают на часовое стекло. Прибавляют 1–2 капли 2н. раствора уксусной кислоты и 5 капель свежеприготовленного реактива Грисса; перемешивают и оставляют стоять в прохладном месте 5–10 мин.
| Раствор окрашивается в зависимости от содержания нитрит-иона в желто-коричневый или красный цвет
|
|
| СН3СОО–
| 5 капель раствора помещают в пробирку, прибавляют 4 капли конц. H2SO4 и 5 капель амилового спирта. Содержимое пробирки перемешивают, нагревают на водяной бане 2–3 мин и выливают в холодную воду.
| Характерный запах грушевой эссенции (амилацетат)
|
|
| СН3СОО–
| 2–3 капли раствора помещают в пробирку, прибавляют 5 капель 10%-ного раствора FeCl3, разбавляют водой в два раза и нагревают.
| Выпадает бурый осадок основного ацетата железа
|
При анализе индивидуального вещества могут быть использованы качественные реакции на катионы и анионы, не указанные в таблицах 18-19.
Рекомендуемая литература
1. Аналитическая химия. В 3т. Т 1 Методы идентификации и определения веществ: учеб. для вузов / А.А. Белюстин[и др.]; под ред. Л.Н. Москвина. – Гриф УМО. – М.: Академия, 2008. -575с.
2. Аналитическая химия. В 3 т. Т.2. Методы разделения веществ и гибридные методы анализа: учеб. для вузов / И.Г. Зенкевич [и др.]; под ред. Л.Н. Москвина. - Гриф УМО. – М.: Академия, 2008.-300 с.
3. Аналитическая химия. Расчеты в количественном анализе [Электронный ресурс]: практикум для студентов вузов / В. П. Гуськова [и др.]. - 2-е изд., испр. и доп. - Кемерово: Кемеров. технол. ин-т пищевой промышленности, 2010. - 123 c.: ил. - ISBN 978-5-89289-633-7.
4. Харитонов Ю.Я. Аналитическая химия. Аналитика. В 2 кн. Кн. 1. Общие теоретические основы. Качественный анализ: учеб. для вузов по фармац. и нехим. спец. / Ю.Я. Харитонов. - Изд. 4-е, стер.; Гриф МО. - М.: Высш. шк., 2008. - 615 с.
5. Лурье, Ю.Ю. Справочник по аналитической химии / Ю.Ю. Лурье. – М.: Химия, 1965. – 390с., 1971. – 454с., 1979. – 480с., 1989. – 447с.