ДНК-лігаза 3 страница1) Зміна первинної структури пептиду Вона може відбуватись, наприклад, при „достиганні” білкової молекули. Такий механізм характерний для активації інсуліну з проінсуліну – з проінсуліну вищеплюється поліпептид: трипсин і хемотрипсин з трипсиногену і хемотрипсиногену – шляхом відщеплення пептиду. 2) Інактивація ферментів шляхом їх гідролізу Цей процес здійснюється цілою системою більш чи менш високо специфічних гідролітичних ферментів – протеаз. 3) Ковалентне приєднання чи відщеплення хімічних груп небілкової природи Прикладами такої модифікації є ферментативні чи неферментативні фосфорилювання, аденілювання, метилювання тощо. Нековалентними механізмами регуляції активності ферментів є чи можуть бути: 1. Доступність і концентрація субстрату, кофактора чи продукту реакції. 2. Регуляція алостеричними модифікаторами – речовинами з того ж шляху, одну із стадій якого каталізує певний фермент, або з інших шляхів. Крім того можлива й регуляція більш чи менш специфічними спеціальними речовинами. 3. Зворотна взаємодія зі структурними речовинами клітини, мембранами, цитоскелетом тощо.
2. ДНК-зв’язуючі білки Невеликі молекули, що беруть участь у регуляції експресії, реалізують, найчастіше, свою дію через так звані регуляторні білки, які специфічно зв’язуються з певними ділянками ДНК. Правда, білки можуть зв’язуватись з ДНК і неспецифічно. Прикладом білків, які взаємодіють з ДНК неспецифічно, є гістони у еукаріотів і гістоноподібні білки у прокаріотів. Вони зв’язуються з ДНК за рахунок електростатичних сил, оскільки несуть позитивний заряд, а нуклеїнові кислоти – негативний. Взаємодія ДНК з гістонами призводить до утворення нуклеосоми. Якщо ДНК входить до складу нуклеосоми, то вона не транскрибується, бо місце зв’язування РНК-полімерази заблоковане. Звільнення ДНК від гістонів робить можливим зв’язування РНК-полімерази. Існує багато білків, які взаємодіють з ДНК у залежний від послідовності спосіб. Ці взаємодії відбуваються за рахунок взаємодії бокових радикалів амінокислот з основами, фосфатом і залишком вуглеводу ДНК. Такого типу взаємодії відбуваються, в основному, в місці великої боріздки ДНК. Висока специфічність взаємодії досягається тим, що білок повинен взаємодіяти щонайменше з кількома нуклеотидними залишками. Нерідко такими місцями виступають так звані інвертовані послідовності. Регуляторні білки, які зв’язуються з ДНК, як правило, гомодимерні, тобто димери, які складаються з двох ідентичних поліпептидів. Кожен з протомерів містить область (домен), яка специфічно взаємодіє з великою боріздкою ДНК. Другий домен відповідає за взаємодію з другим протомером.
Рис. 6.2. Взаємодія ДНК та ДНК-зв’язуючих білків. Загальний принцип.
Така загальна структура характерна для регуляторних білків про- та еукаріотів. Загальним типом є так звана структура спіраль-поворот-спіраль. Розпізнавання специфічних послідовностей ДНК здійснюється за рахунок нековалентних взаємодій, включаючи водневі та Ван-дер-Ваальсові сили. Інша група регуляторних ДНК-зв’язуючих білків називається цинковий палець, їх часто знаходять у еукаріотів.
Рис. 6.2. Утворення зв’язку між „цинковим пальцем” та ДНК.
Ділянка α-спіралі, відповідальна за зв’язування з іоном Zn2+, містить два залишки гістидину. В іншій частині молекули є два залишки цистеїну. α-спіраль відповідає за зв’язування з ДНК. Кожен зв’язуючий білок містить не менше двох цинкових пальців. Третій тип ДНК-зв’язуючих регуляторних білків називають лейцинова блискавка.
Рис. 6.3. Взаємодія „лейцинової блискавки” з ДНК.
Ця субструктура утворена боковими залишками лейцину, розташованими через кожних сім амінокислотних залишків. Лейцинова блискавка відповідає за взаємодію двох протомерів. Другий домен білка взаємодіє з нуклеїновими кислотами. Взаємодія регуляторних білків з ДНК запускає цілу послідовність подій, як-то взаємодію РНК-полімерази. В інших випадках взаємодія білків з ДНК може блокувати або активувати транскрипцію.
3. Репресія (негативний контроль) Загальний принцип репресії полягає у специфічному блокуванні оператора гену (генів). Діями білка-репресора керує так званий корепресор. Як правило, це малі молекули, які, зв’язуючись з білком-регулятором, блокують репресію.
Рис. 6.4. Загальний принцип репресії.
4. Індукція Дещо подібно до репресії функціонує і механізм індукції. У цьому випадку білок-регулятор зв’язаний з оператором гену і, таким чином, блокує транскрипцію. Індуктор, як правило, невелика молекула, яка взаємодіє з репресором. Така взаємодія викликає конформаційні зміни в молекулі репресора і, таким чином, індукує його дисоціацію від оператора. Тому РНК-полімераза отримує можливість розпочати транскрипцію.
Рис. 6.5. Регуляція експресії генів за участю білка-індуктора.
Молекули, які регулюють експресію – репресори та індуктори, прийнято об’єднувати під назвою ефектори. Не всі ефектори мусять бути субстратами чи продуктами функціонування генів, які беруть участь у метаболізмі цих ефекторів, як це є у випадку триптофанового чи лактозного оперонів у бактерій. Ними можуть бути аналоги відповідних метаболітів. Наприклад, ізопропілтіогалактозид є індуктором β-галактозидази, хоча й не гідролізується цим ферментом. Проте, в природі індуктори та корепресори найчастіше є нормальними клітинними метаболітами.
5. Механізми індукції та репресії Дані механізми реалізуються на рівні транскрипції. Тобто при індукції запускається транскрипція, а при репресії – пригнічується. Репресія регулюється білком репресором, який є специфічним білком, наприклад, аргініновим репресором. Репресор є алостеричним білком і змінює свою конформацію при взаємодії з корепресором. Змінений білок-репресор взаємодіє зі специфічною ділянкою ДНК біля промотора гену – в області оператора. В результаті взаємодії блокується функціонування РНК-полімерази. Індукція також блокується білком-репресором. Аналогічно, репресор зв’язаний з оператором гену (регулону). Взаємодія з ним індуктора викликає конформаційні зміни, що призводять до дисоціації репресора з оператором і, таким чином, „дозволяє” синтез РНК. Оскільки роль репресора полягає в інгібуванні транскрипції, то такий механізм називають неактивним контролем.
6.Конститутивні ферменти (білки) та базальний рівень експресії Далеко не всі білки в клітині контролюються простою індукцією чи репресією, а синтез багатьох з них не контролюється сильно клітиною. Білки, швидкість синтезу яких приблизно однакова незалежно від умов, називають конститутивними. Прикладом таких білків можуть бути білки мембран, міофібрил тощо. Інший приклад дають продукти генів, які постійно існують в клітині, але за певних умов їх вміст може різко зростати. Тобто постійно відбувається їх синтез з відносно низькою інтенсивністю. Такий синтез називають базальним. Зміна умов середовища викликає різке підвищення вмісту продуктів певних генів. Прикладом такого типу генів є одна з каталаз бактерій E. coli. Даний фермент експресується постійно. Проте, при збільшенні вмісту в середовищі його субстрату – Н2О2 – активність зростає в кілька разів.
7. Оперони та регулони У мікроорганізмів експресія кількох генів може регулюватись однією регуляторною ділянкою – промотором. Такий тип організації геному прийнято називати опероном.
Класичним прикладом є лактозний оперон E. coli, описаний ще в 60–х роках. Йому буде присвячено цілу лекцію. У бактерій також відомо, що під контролем одного і того ж регуляторного білка може знаходитись кілька оперонів. Їх називають регулоном. Прикладом регулонів є мальтозний. Цей регулон знаходиться під, так званим, позитивним контролем. Аргініновий регулон знаходиться під негативним контролем аргінінового репресорного білка. Останніми роками детально вивчено функціонування двох регулонів E. coli та їх аналогів у інших бактерій. Ці регулони, названі SoxRS та OxyR, об’єднують ферменти, які беруть участь у захисті від активованих форм кисню – супероксид-аніону, пероксиду водню та інших. Регуляторні білки цих регулонів активують експресію генів, що кодують антиоксидантні та функціонально зв’язані з ними білки, а також ряд репараційних ферментів та ряд білків, функцію яких не встановлено. Цим регулонам також буде присвячено окрему лекцію.
8. Позитивний контроль При цьому типі контролю регуляторний білок покращує зв’язування РНК-полімерази з ДНК і, таким чином, збільшує синтез ДНК. Прикладом позитивного контролю є регуляція катаболізму мальтози у E. coli. Ферменти мальтозного оперону у E. coli синтезуються тільки після додавання в середовище мальтози.
Рис. 6.6. Швидкість росту клітин E. сoli від типу середовища.
Система аналогічна з функціонуванням лактозного оперону. Суть процесу полягає в тому, що, якщо в клітині з’являється індуктор, то він зв’язується з існуючим активаторним білком. Це викликає зв’язування молекули активаторного білка зі специфічною ділянкою ДНК, що знаходиться або поруч з промотором, або на певній відстані від нього. Утворення такого комплексу – ДНК-РНК-полімераза-активаторний білок-індуктор викликає реплікацію.
Рис. 6.7. Позитивний контроль експресії генів E. сoli.
Яким чином здійснюється позитивний контроль? Позитивно контрольовані промотори мають нуклеотидні послідовності, які не є абсолютно консенсусними. Навіть в присутності коректного σ-фактора (субодиниця РНК-полімерази) РНК-полімераза важко розпізнає ці промотори. Активаторний білок, зв’язуючись з ДНК, допомагає РНК-полімеразі або розпізнати промотор, або розпочати транскрипцію. Зокрема, активаторний білок може змінювати структуру ДНК, наприклад зігнути її. Це дозволяє РНК-полімеразі коректно взаємодіяти з ДНК. Активаторний білок може безпосередньо взаємодіяти з ДНК. Це можливо у випадку, коли ділянка зв’язування знаходиться поруч з промотором, або навіть за кількасот пар основ. У другому випадку для активації необхідно утворити петлю молекули ДНК.
Рис. 6.8. Утворення петлі ДНК за участю білка-індуктора.
У E. coli багато генів знаходиться під позитивним чи негативним контролем. Проте, відомі і інші системи контролю. Багато генів, а, може, й більшість, мають промотори з багатьма типами контролю, або мають більше одного промотора. Кожен з цих промоторів має свою власну систему контролю.
9. Альтернативні σ-фактори Ще один механізм контролю експресії генів забезпечує структура молекули РНК-полімерази. До її складу входить так званий серцевинний фермент. Тобто, власне РНК-полімераза і σ-фактори. Серцевинний фермент сам здатний забезпечувати синтез РНК. Проте для його зв’язування з ДНК необхідна наявність σ-фактора. Після того, як буде синтезовано кусок РНК, σ-фактор дисоціює і серцевинний фермент продовжує транскрипцію. У клітині є кілька σ-факторів, вміст яких контролюється багатьма чинниками. Кожен σ-фактор високоспецифічно розпізнає „свої” промотори. Тому за решти однакових умов будуть транскрибуватись ті гени, які достатньо „забезпечені” σ-факторами. Тобто співвідношення вмісту різних σ-факторів визначає, з яким з промоторів зв’яжеться РНК-полімераза. Багато чинників можуть впливати на вміст того чи іншого σ-фактору. Так, у E. coli поруч із „стандартним” σ-фактором σ30 описано σ5-фактор. Його вміст різко зростає при переході культури E. coli з логарифмічної у стаціонарну фазу. Тому фактор і отримав σ-3 (staсіonary, starvation). Він регулює функціонування клітин в стадії голодування і керує радикальною перебудовою всього метаболізму клітини, викликає зміну форми клітин, їх стійкості до несприятливих чинників зовнішнього середовища. До речі, його синтез не залежить від стадії розвитку культури, а вміст збільшується за рахунок підвищення стійкості білкової молекули. Тобто регуляція відбувається на посттрансляційному рівні.
10. Аттенуація Описані вище системи контролю характеризували регуляцію транскрипції при ініціації. Тобто, репресор блокував транскрипцію, а активатор – збільшував її. Але в обох випадках регуляція відбувається на стадії ініціації. Аттенуація забезпечує інший тип регуляції – після початку, але перед закінченням. Сам термін аттенуація означає затухання, зменшення кількості (attenuation). Першою описаною системою такого типу був триптофановий оперон E. coli.
Рис. 6.9. Структура триптофанового оперону E. сoli.
Рис. 6.9. Регуляція експресії триптофанового оперону E. Сoli за типом аттенуації. Особливістю даного механізму регуляції є те, що коли синтезується лідерний пептид, транскрипція структурних генів синтезу триптофану зупиняється. З іншого боку, якщо синтез лідерного пептиду блокований через дефіцит триптофану, відбувається синтез структурних генів біосинтезу триптофану. Функціонування механізму аттенуації можливе завдяки одночасному протіканні у прокаріотів транскрипції та трансляції. Після того, як синтезована РНК відходить від ДНК, рибосома зв’язується з першою і починається трансляція. Аттенуація відбувається, бо частина синтезованої молекули іРНК утворює подвійну петлю, що слугує сигналом для закінчення синтезу РНК. Утворення структури стебла-петлі відбувається, бо існують дві комплементарних пари основ. Якщо триптофану багато, рибосома транслює лідерну послідовність поки не дійде до стоп-кодону. Залишок лідерної РНК утворює стебло-петлю – місце паузи транскрипції, за яким слідує багата урацилом послідовність, що фактично викликає термінацію. Проте, при дефіциті триптофану рибосома зупиняється на триптофановому кодоні і це дозволяє утворитись альтернативній петлі. Така структура стебло-петля не є термінальним сигналом, що ефективно попереджує утворення термінатора. РНК-полімераза проходить накладену термінаторну ділянку і починає транскрипцію структурних генів триптофанового оперону. Таким чином, аттенуація забезпечується чіткою взаємодією між транскрипцією та трансляцією. В шляху біосинтезу триптофану репресія являє собою механізм з сильними ефектами, а аттенуація – тонший механізм контролю. Разом обидва механізми забезпечують тонку регуляцію. Аттенуація у E. coli виявлена в шляхах біосинтезу гістидину, треоніну, ізолейцину, фенілаланіну та ряду інших амінокислот та метаболітів. Лідерні пептиди оперонів синтезу відповідних амінокислот багаті саме цими амінокислотами. Крайній приклад з відомих випадків подає гістидиновий оперон, лідерний пептид якого містить 6 залишків гістидину підряд. B. subtilis – грампозитивні бактерії, в яких аттенуація також регулює експресію триптофанового оперону. Проте, тут є так званий триптофановий аттенуаційний білок, який в присутності триптофану зв’язується з лідерним пептидом і викликає термінацію. Якщо немає триптофану, то білок не зв’язується і не викликає термінації. У B. subtilis та E. coli аттенуація бере участь в регуляції біосинтезу піримідинів. Описана також трансляційна аттенуація. У цьому випадку трансляція лідерного пептиду блокує трансляцію наступних генів поліцистронної іРНК. Цей механізм регулює експресію кількох генів резистентності до антибіотиків грампозитивних бактерій.
11. Глобальний контроль Часто організм має потребу регулювати одночасно багато різних генів у відповідь не зміну зовнішніх умов. Так, у E. coli при дефіциті фосфору експресуються понад 80 різних генів. Кодовані ними білки необхідні для адаптації до даних умов. У E. coli виявлено кілька наборів таких генів. Наприклад, температурний шок викликає індукцію альтернативних σ-факторів, дефіцит NH3 активує систему використання азоту через експресію активатора і синтез альтернативного σ-фактору; оксидативний стрес, викликаний окисниками, індукує активатори; спеціальні білки – SOS-відповідь – активується при пошкодженні ДНК і активує спеціальний білок-репресор. У всіх цих випадках регулюється експресія більш як 10 генів. А ось катаболітична репресія, викликана цАМФ індукує активатор, який регулює понад 300 генів. Оскільки задіяно багато регуляторних шляхів, то говорять про системи глобального контролю, які можуть включати один чи більше регулонів. Інколи в даному випадку використовується термін стимулон. В ряді випадків використовується термін модулон, чим підкреслюють, що глобальний контроль часто модулює різні контролі тих самих генів. Одною з найкраще вивчених систем глобального контролю є катаболітна репресія. Цей механізм було вперше описано в системі, коли є легко катаболізоване джерело енергії, наприклад, глюкоза, разом з іншими, важче метаболізованими вуглеводами. Тому іноді даний механізм ще називають ефектом глюкози, хоча в деяких організмах глюкоза не викликає подібних ефектів. При цьому шляхи, які відповідають за катаболізм інших вуглеводів пригнічуються. Одним з наслідків катаболітної репресії є так званий диауксичний ріст. Дане явище має місце, коли, наприклад, бактерії ростуть на середовищі з двома джерелами енергії і, якщо ферменти, відповідальні за катаболізм одного з цих вуглеводів, є об’єктом катаболітної репресії з боку другого джерела енергії. При диауксичному рості організм спочатку росте на одному джерелі енергії, а після його виснаження тимчасово пропиняє інтенсивний ріст, синтезує ферменти для катаболізму другого вуглеводу і потім відновлює високу швидкість росту. Приклад – ріст E. coli на суміші глюкози та лактози. Синтез β-галактозидази індукується, коли в середовищі вичерпана глюкоза.
Рис. 6.10. Ріст E. coli на суміші глюкози та лактози.
Катаболітна репресія включає контроль транскрипції активаторним білком. У випадку катаболітно репресованих ферментів, РНК-полімераза зв’язується лишень тоді, коли інший білок, який називається катаболітний активаторний білок (catabolite activator protein, CAP) зв’язується першим. Алостеричний САР-білок зв’язується з ДНК тільки після зв’язування з ним цАМФ. Глюкоза інгібує синтез цАМФ аденілатциклазою і стимулює його транспорт з клітини. Коли глюкоза транспортується в клітину, рівень цАМФ падає. В результаті РНК-полімераза не зв’язується з промотором. Тобто, катаболітна репресія є результатом дефіциту цАМФ і може бути знята додаванням цієї речовини в середовище. Хоча це може виглядати як звичайна система позитивної регуляції, кожен з оперонів, які контролюються САР-системою, знаходяться під контролем специфічного регуляторного білка. Тому, оскільки катаболітична репресія модулює кілька пов’язаних регуляторних систем, і вона є прикладом глобального контролю. В присутності у середовищі глюкози, катаболітна репресія блокує експресію всіх інших катаболітних оперонів, які контролюються цим глобальним контролюючим елементом. Для протікання транскрипції необхідно задовільнити дві вимоги: 1) рівень цАМФ повинен бути достатньо високим, щоб САР-білок зв’язався з САР-зв’язуючою ділянкою ДНК; 2) повинен бути індуктор, такий як лактоза, щоб лактозний репресор не блокував транскрипцію зв’язуванням з оператором. Відомі й інші системи глобального контролю, не всі з яких використовують прості комбінації репресорів чи активаторів. Деякі з них включають альтернативні σ-фактори. Їх регуляторна роль може змінюватись або через модифікацію кількості, або їх активності. Більшість генів E. coli вимагають σ30 фактора. Він має молекулярну масу 70кД. Гени, які індукуються збільшенням температури (температурний шок), мають промотори з досить різними послідовностями і РНК-полімерази потребують інших σ-факторів (σ32) для їх розпізнавання. Кількість альтернативного σ-фактора регулює відповідь на температурний шок. Стаціонарний рівень фактора σ32 не контролюється транскрипцією, а підвищенням його стабільності. У E. coli σ32 розпізнається спеціальними протеазами і швидко деградує – за 1-2 хвилини після синтезу. При тепловому шоці деградація інгібується. В результаті вміст σ32 збільшується, що направляє більше молекул РНК-полімерази до промоторів генів теплового шоку. Системи глобального контролю повинні мати спільний шлях передачі сигналу з середовища до гену (генів). У випадку теплового шоку задіяний один з білків теплового шоку, який називається DnaK. Цей білок необхідний для росту E. coli за нормальних умов, але його синтез збільшується температурним шоком. DnaK є чапероніном – представником групи білків, яких називають молекулярними чаперонами. Він якимось чином допомагає іншим білкам вірно укладатись і він же задіяний у деградації σ32. Вважається, що при підвищеній температурі активність DnaK направлена більше на укладку білків і менше доступна для деградації σ32. Тому рівень σ32 збільшується і в результаті зростає транскрипція генів, промотори яких розпізнаються σ32. Проте, оскільки рівень DnaK зростає як частина відповіді на тепловий шок, то, з часом, і прискорюється деградація σ32. В результаті метаболізм повертається до нормального. Нерідко, різні шляхи глобальної регуляції впливають на транскрипцію одних і тих самих оперонів. Наприклад, lac -оперон регулюється лактозним репресором і катаболітним активаторним білком (САР). В цьому випадку кожен регуляторний білок фактично діє незалежно один від другого. Відомі й інші системи, коли по меншій мірі два білки задіяні у відповіді на одиничний сигнал. Такий тип регуляції розповсюджений досить широко.
12. Проведення сигналу і двокомпонентні регуляторні системи У багатьох випадках зовнішній сигнал не передається безпосередньо до регуляторного білка. Сигнал детектується сенсором, а далі передається у зміненій формі на решту регуляторної машини. Цей процес називається передачею сигналу. Сенсорні кінази і регулятори відповіді
Рис. 6.11. Сприйняття і передавання сигналу сенсорними кіназами. Багато регуляторних систем, які задіяні у відповіді клітин на зовнішні сигнали називають двокомпонентними системами. Такі системи мають два різні білки: 1) специфічний сенсорний білок, локалізований на клітинній мембрані; 2) партнерний білок-регулятор відповіді. Сенсорний білок має кіназну активність і його часто називають сенсорною кінaзою. Ця кіназа детектує сигнал із середовища і фосфорилює сама себе по специфічному залишку гістидину, що локалізується з боку цитоплазми. Такий тип фосфорилювання називається автофосфорилювання. Далі сигнал переноситься всередину клітини білком-регулятором відповіді. Білок-регулятор відповіді є звичайно ДНК-зв’язуючим білком, що регулює транскрипцію. В нефосфорильованому стані він не зв’язується з ДНК. Фосфобілок, зв’язуючись з оператором, активує транскрипцію. Дефосфорилювання його фосфатазою викликає дисоціацію від ДНК. У E. coli осмолярність середовища контролює, який з двох білків OmpC чи OmpF синтезується як частина зовнішньої мембрани. Регулятором відповіді виступає білок OmpR. Коли OmpR фосфорильований, він діє як активатор транскрипції гену ompC і репресор транскрипції гену оmpF. У E. coli вивчено щонайменше 50 різних двокомпонентних регуляторних систем. Подібні системи знайдені у нижчих еукаріотів, зокрема, у Saccharomyces cerevisiae. У ряді випадків регулятор відповіді дефосфорилюється сам, а в ряді – це здійснює спеціальний білок – фосфатаза. Певні регулятори відповіді не регулюють транскрипцію, а поведінку клітини, наприклад хемотаксис. Механізм хемотаксису досить складний. На зовнішньому боці мембрани є сенсорні білки, які відчувають наявність атрактантів чи репелентів. Вони дозволяють клітині відчувати концентрацію речовин в часі, тобто зміну концентрації при русі клітини. Клітина відповідає на зміну концентрації, а не на абсолютну концентрацію. Сенсорні білки називають метил-акцепторними білками хемотаксису (MCP1 – methyl-accepting chemotaxis), або рецептор-трансдукторними білками, або просто трансдукторами. У E. coli ідентифіковані 4 різних MCP1. Всі вони трансмембранні білки. Кожен з них відчуває певний набір речовин. Наприклад, Tar – трансдуктор E. coli відчуває атрактанти: аспартат і мальтозу, і репеленти – іони важких металів – кобальт і нікель.
Рис. 6.12. Механізм хемотаксису. MCP1 зв’язує атрактант чи репелент або безпосередньо, або через периплазматичні зв’язуючі білки. Зв’язування ефектора викликає обертання війки. Якщо вона крутиться проти годинникової стрілки – бактерія продовжує рухатись, а якщо за ходом годинникової стрілки – бактерія кувиркається. Трансдуцери контактують з цитоплазматичними білками CheW і CheA. CheA – сенсорна кіназа у цій двокомпонентній системі. Зв’язування речовини з трансдуктором індукує конформаційні зміни і з CheW викликає автофосфорилювання CheA. Атрактанти знижують рівень автофосфорилювання, а репеленти – збільшують його. Фосфорильваний CheA фосфорилює CheY – регулятор відповіді. CheY взаємодіє з мотором війки, індукуючи обертання війки за годинниковою стрілкою. Мотор вмикається сам і складається з білків, кодованих генами fla. СheA-P може також фосфорилювати CheB – інший регулятор відповіді, але значно повільніше, ніж CheY. CheY є головним білком системи, бо саме він керує напрямком обертання війки. Коли CheY фосфорильований, мотор війки переключається з ходу проти годинникової стрілки на хід за нею, викликаючи зависання клітини. Нефосфорильований CheY не може зв’язуватись і клітина рухається. Інший білок CheZ дефосфорилює CheY. Оскільки репеленти збільшують рівень CheY-P вони зупиняють клітину, а атрактанти знижують рівень CheY-P і клітина продовжує наступальний рух. Дана система сигналізує, що певна речовина є середовищі. Але вона не здатна відзначити зміни концентрації в часі. Є інший – адаптаційний компонент системи. MCP1 білок може бути метильований. Існує цитоплазматичний білок CheR, який постійно приєднує метильні групи з S-аденозилметіоніну до MCP1 з низькою швидкістю. Фосфорильована форма CheB – деметилаза, яка від’єднує метильні групи від MCP1. Рівень метилювання MCP1 впливає на їх конформацію і дозволяє підтримувати рецептор у стані подання сигналу, хоча концентрація речовини залишається незмінною.
|




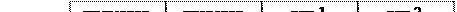
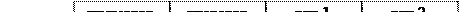



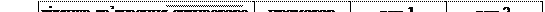


 На рисунку приведено структуру триптофанового оперону E. coli. Він складається з 5 генів для 5 білків біосинтезу триптофану, а також містить промотор і регуляторну послідовність на початку оперону. Цей оперон має регуляції більше одного типу. Одним із них є репресія. Окрім областей промотора і оператора, є послідовність, яку називають лідерною. Вона кодує поліпептид, який містить тандем триптофанових кодонів біля їх кінця, які функціонують як аттенуатор. Якщо в клітині багато триптофану, то синтезується лідерний пептид. Якщо триптофану мало, то лідерний білок не синтезується.
На рисунку приведено структуру триптофанового оперону E. coli. Він складається з 5 генів для 5 білків біосинтезу триптофану, а також містить промотор і регуляторну послідовність на початку оперону. Цей оперон має регуляції більше одного типу. Одним із них є репресія. Окрім областей промотора і оператора, є послідовність, яку називають лідерною. Вона кодує поліпептид, який містить тандем триптофанових кодонів біля їх кінця, які функціонують як аттенуатор. Якщо в клітині багато триптофану, то синтезується лідерний пептид. Якщо триптофану мало, то лідерний білок не синтезується.






