Молекулярная рефракцияРефракция света – изменение направления световых лучей в среде с переменным показателем преломления. Преломление света является частным случаем резкого изменения направления лучей на границе раздела двух сред с разными показателями преломления.
p =α E, где α – поляризуемость атома (или молекулы), E – напряженность электрического поля падающей волны. Дипольный момент атома колеблется с частотой падающего света, и атом становится источником вторичных когерентных волн. Колебания электрона запаздывают по фазе относительно колебаний исходной световой волны, поэтому вторичные волны также излучаются с запаздыванием. Поле вторичных волн складывается с полем исходной световой волны, что и служит причиной замедления результирующей электромагнитной волны. Классическая электронная теория позволяет связать показатель преломления вещества с микроскопическими характеристиками среды – плотностью и электронной поляризуемостью, зависящей от природы атомов или молекул и частоты света. Через микроскопические характеристики выражают обычно не сам показатель преломления, а связанную с ним молекулярную рефракцию:
где R – молекулярная рефракция [см3/моль], M – молекулярная масса [г/моль], ρ – плотность [г/см3], NA = 6,023∙1023 – число Авогадро [моль-1],
Молекулярная рефракция – это физическая величина, характеризующая поляризуемость молекулы, а точнее – 1/3 моля вещества. Ее измерение основано на измерении показателя преломления и плотности вещества. Разные модели строения вещества приводят к несколько различным выражениям для функции f(n); чаще всего применяется формула Лоренц-Лорентца, согласно которой
то есть является характеристикой химического соединения. Значения R в видимой области спектра характеризуют поляризуемость электронных оболочек молекул вещества. Если при растворении не изменяется поляризуемость компонентов, то рефракция растворов слагается из Ri рефракции компонентов:
где xi – концентрация i -го компонента в мольных долях. Правило аддитивности молекулярных рефракций растворов позволяет вычислить R растворенных твердых веществ. Более того, аддитивность молекулярной рефракции приблизительно соблюдается и для чистых соединений. Для ионных соединений она равна сумме ионных рефракций (см. табл.1 в Приложении). Пример 1. Хлорид калия Расчетная Rтеор(KCl) = R(K+) + R(CI–) = 2,2 + 8,7 = 10,90; Молярная масса M(KCl) = 74,56 г/моль; Плотность ρ(KCl)=1,985 г/см3; Показатель преломления для желтой линии D натрия при температуре 20 градусов по Цельсию n D20(KCl) = 1,490; тогда рассчитанная из эксперимента
Получаем погрешность Δ R = 0,04 и относительную погрешность Молекулярная рефракция соединений с валентными связями может быть представлена в виде суммы атомных рефракций (см. табл.2 в Приложении). Пример 2. н-Пентан СН3–(СН2)3–СН3 Rтеор(C5H12) = 5R(C) + 12R(H) = 5∙2,418 + 12∙1,100 = 25,290; M(C5H12) = 72,15 г/моль; ρ(C5H12)=0,62619 г/см3; n D20(C5H12) = 1,35769;
Получаем погрешность Δ R = 0,008 и относительную погрешность Фигурирующие в подобных расчетах атомные рефракции частично включают эффекты взаимного влияния атомов и не равны атомным рефракциям соответствующих простых веществ. Влияние структуры молекулы на молекулярную рефракцию учитывается путем введения различных значений атомных рефракций для одного и того же элемента в различных группировках (например, различные атомные рефракции для кислорода в эфирах, спиртах и карбоксильных соединениях (см. табл.2 в Приложении)) или путем применения групповых рефракций (например, групповые рефракции групп NO, N02, CN и т.д.), а также путем использования специальных инкрементов (т.е. приращений) для кратных связей (двойная связь С=С, тройная связь С≡С). Вместо атомных и групповых рефракций часто применяются рефракции связей, причем молекулярная рефракция разлагается на слагаемые по числу и типам связей, которым условно приписывается и поляризуемость электронов, не участвующих в образовании связей (см. табл.3 в Приложении). Пример 3. 1-Бромпропан СН3–СН2–СН2–Br Rтеор(C3H7Br) = 7R(C–H) + 2R(C–C) + R(C–Br) = 7∙1,70 + 2∙1,21 + 9,47 = 23,79; M(C3H7Br) = 123,00 г/моль; ρ(C3H7Br)=1,353 г/см3; n D20(C3H7Br) = 1,4344;
Получаем погрешность Δ R = 0,10 и относительную погрешность Пример 4. 2-Бромпропан СН3–СНBr–СН3 Rтеор(C3H7Br) = 23,79 (т.к. число и качество связей такое же как и в 1-бромпропане); M(C3H7Br) = 123,00 г/моль; ρ(C3H7Br)=1,310 г/см3; n D20(C3H7Br) = 1,4256;
Получаем погрешность Δ R = 0,3 и относительную погрешность Нельзя сказать, что в какой-то схеме (по атомам или по связям) аддитивность выполняется лучше. Обе они приблизительно равнозначны в пределах границ применимости аддитивной схемы для молекулярной рефракции. Пример 5. Бромоформ СНBr3
По атомам Rтеор(CHBr3) = R(C) + R(H) + 3R(Br) = 2,418 + 1,100 + 3 ∙ 8,865 = 30,113 (см. табл.2 в Приложении); По связям Rтеор(CHBr3) = R(C–H) + 3R(C–Br) =1,70 + 3 ∙ 9,47 = 30,11(см. табл.3 в Приложении); Δ R ≈ 0,3 и Иногда суммирование молекулярной рефракции по связям дает несколько лучшие результаты, чем суммирование по атомам. Пример 6. Этиловый спирт СН3–CH2–OH
Rтеор(C2H5OH) = 2R(C) + 6R(H) + R(O в спиртовой группе) = 12,961 (см. табл.2 в Приложении); Rтеор(C2H5OH) = 5R(C–H) + R(C–С) + R(C–O) + R(O–H) = 13,05 (см. табл.3 в Приложении); Соответственно и Сопоставление экспериментального значения молекулярной рефракции с вычисленным по аддитивным схемам – один из простейших физических методов определения строения химических соединений. Этим методом может быть получено подтверждение брутто-формулы вещества и наличия определенных функциональных групп, (например, может быть получена информация о числе колец в молекуле, числе, природе и расположении кратных связей и т.д.). В некоторых случаях возможны также заключения о цис- или транс-конфигурации молекулы.
|

 , (6)
, (6)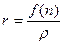 – удельная рефракция [см3/г].
– удельная рефракция [см3/г]. .Здесь использована не система СИ, а старая система СГС, в соответствии с которой приведены данные в большинстве химических справочников. Как видно из последней части формулы (6), молекулярная рефракция не зависит от температуры и плотности, а, следовательно, давления и агрегатного состояния и является мерой только поляризуемости α молекул:
.Здесь использована не система СИ, а старая система СГС, в соответствии с которой приведены данные в большинстве химических справочников. Как видно из последней части формулы (6), молекулярная рефракция не зависит от температуры и плотности, а, следовательно, давления и агрегатного состояния и является мерой только поляризуемости α молекул: , (7)
, (7)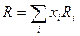 , (8)
, (8)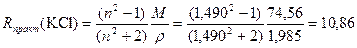 .
. или 0,4%.
или 0,4%. .
.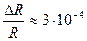 или 0,03%.
или 0,03%.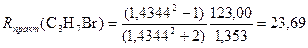 .
. .
. или 1,0%.
или 1,0%.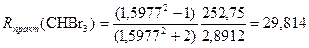 ;
; или 1,0%.
или 1,0%. ;
;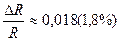 и 2∙10-3(0,2%).
и 2∙10-3(0,2%).


