Температура — мера средней кинетической энергии молекул
Для того чтобы сравнить уравнение состояния идеального газа и основное уравнение молекулярно-кинетической теории, запишем их в наиболее совпадающем виде.
Из этих соотношений видно, что:
где
величина, которая называется постоянной Больцмана — коэффициент, позволяющий энергию движения молекул (конечно, среднюю) выражать в единицах температуры, а не только в джоулях, как до сих пор. Как уже говорилось, «объяснить» в физике означает установить связь нового явления, в данном случае — теплового, с уже изученным — механическим движением. Это и есть объяснение тепловых явлений. Именно с целью находить такое объяснение в настоящее время разработана целая наука — статистическая физика. Слово «статистическая» означает, что объекты исследования — это явления, в которых участвует множество частиц со случайными (у каждой частицы) свойствами. Исследование таких объектов у человеческих множеств — народов, населения — предмет статистики. Именно статистическая физика является основой химии как науки, а не как в поваренной книге — «слейте то и то, получится, что надо!» Почему получится? Ответ в свойствах (статистических свойствах) молекул. Отметим, что, конечно, возможно использование найденных связей энергии движения молекул с температурой газа и в другом направлении для выявления свойства самого движения молекул, вообще свойств газа. Например, ясно, что внутри газа молекулы обладают энергией:
Эта энергия так и называется — внутренняя. Внутренняя энергия есть всегда! Даже когда тело покоится и не взаимодействует ни с какими другими телами, оно обладает внутренней энергией. Если молекула — не «кругленький шарик», а представляет собой «гантель» (двухатомную молекулу), то кинетическая энергия представляет собой сумму энергии поступательного движения (только поступательное движение и рассматривалось фактически до сих пор) и вращательного движения (рис. 1.18).
Рис. 1.18. Вращение молекулы Произвольное вращение можно представить себе как последовательное вращение сначала вокруг оси x, а затем вокруг оси z. Запас энергии такого движения ничем не должен отличаться от запаса движения по прямой. Молекула «не знает» — летит она или крутится. Тогда во всех формулах необходимо вместо числа «три» ставить число «пять».
Такие газы, как азот, кислород, воздух и т. д., нужно рассматривать именно по последним формулам. Вообще, если для строгой фиксации молекулы в пространстве нужно i чисел (говорят «i степеней свободы»), то
Как говорят, «по пол kT на каждую степень свободы». 1.9. Растворенное вещество
Представления об идеальном газе находят интересные приложения в объяснении осмотического давления, возникающего в растворе. Пусть среди молекул растворителя находятся частицы какого-либо другого растворенного вещества. Как известно, частицы растворенного вещества стремятся занять весь доступный объем. Растворенное вещество расширяется совершенно так же, как расширяется газ, чтобы занять предоставленный ему объем. Подобно тому, как газ оказывает давление на стенки сосуда, растворенное вещество оказывает давление на ту границу, которая разделяет раствор от чистого растворителя. Такое дополнительное давление называется осмотическим давлением. Это давление можно наблюдать, если отделить раствор от чистого растворителя полунепроницаемой перегородкой, через которую легко проходит растворитель, но не проходит растворенное вещество (рис. 1.19).
Рис. 1.19. Возникновение осмотического давления в отсеке с растворенным веществом Частицы растворенного вещества стремятся раздвинуть перегородку, и если перегородка мягкая, то она выпучивается. Если же перегородка жестко закреплена, то фактически смещается уровень жидкости, уровеньраствора в отсеке с растворенным веществом повышается (см. рис. 1.19). Подъем уровня раствора h будет продолжаться до тех пор, пока возникшее гидростатическое давление ρ gh (ρ — плотность раствора) не окажется равным осмотическому давлению. Имеется полное сходство между молекулами газа и молекулами растворенного вещества. И те, и другие находятся далеко друг от друга, и те, и другие движутся хаотически. Конечно, между молекулами растворенного вещества находится растворитель, а между молекулами газа ничего нет (вакуум), но это ведь не важно. Вакуум при выводе законов не использовался! Отсюда следует, что частицы растворенного вещества в слабом растворе ведут себя так же, как молекулы идеального газа. Иначе говоря, осмотическое давление, оказываемое растворенным веществом, равно давлению, которое производило бы это же вещество в газообразном состоянии в том же объеме и при той же температуре. Тогда получим, что осмотическое давление π пропорционально температуре и концентрации раствора (числу частиц n в единице объема).
Этот закон называется законом Вант-Гоффа, формула (1.53) — формулой Вант-Гоффа. Полное сходство закона Вант-Гоффа с уравнением Клапейрона–Менделеева для идеального газа очевидно. Осмотическое давление, разумеется, не зависит от вида полупроницаемой перегородки или от рода растворителя. Любые растворы с одинаковой молярной концентрацией оказывают одинаковое осмотическое давление. Сходство в поведении растворенного вещества и идеального газа обусловленно тем, что в разбавленном растворе частицы растворенного вещества практически не взаимодействуют между собой, как не взаимодействуют и молекулы идеального газа. Величина осмотического давления часто довольно значительна. Например, если в литре раствора содержится 1 моль растворенного вещества, то по формуле Вант-Гоффа при комнатной температуре имеем π ≈ 24 атм. Если растворенное вещество при растворении разлагается на ионы (диссоциируется), то по формуле Вант-Гоффа π V = NkT (1.54) можно определить общее число N образовавшихся частиц — ионов обоих знаков и нейтральных (недиссоциированных) частиц. И, следовательно, можно узнать степень диссоциации вещества. Ионы могут быть сольватированы, но это обстоятельство не сказывается на справедливости формулы Вант-Гоффа. Формулу Вант-Гоффа часто используют в химии для определения молекулярных масс белков и полимеров. Для этого к растворителю объема V добавляют m грамм исследуемого вещества, измеряют давление π. Из формулы
находят молекулярную массу.
|


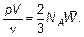
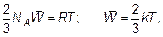 (1.48)
(1.48)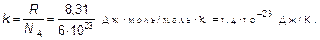 (1.49)
(1.49)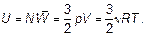 (1.50)
(1.50)
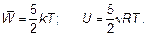 (1.51)
(1.51)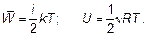 (1.52)
(1.52)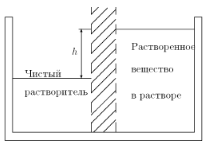
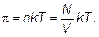 (1.53)
(1.53)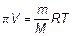 (1.55)
(1.55)


