Проверка технологической концепции материальным и энергетическим балансами
Начальная технологическая концепция основана на лабораторных исследованиях. Дальнейшее ее развитие требует проведения работ в большем масштабе или соответствующих расчетов. Первая стадия технологической концепции включает в себя разработку технологической схемы всего процесса. Основой для оценки технологической концепции процесса, его проведения и контроля служат материальный и тепловой балансы. При составлении баланса учитываются отдельные балансы его единичных элементов. Правильное составление баланса часто требует применения термодинамики, термохимии, химической кинетики, инженерной химии и технической физики. Анализ балансов технологического процесса выявляет недостатки предложенного способа производства. При анализе, прежде всего, устанавливают, можно ли при правильном использовании основных технологических принципов улучшить выходы и исключить недостатки данного метода.
Пример1 Производство серной кислоты из сероводорода. Сероводород, содержащий 94% серы, извлекают из промышленных и природных горючих газов. Концентрация в них сероводорода колеблется в пределах 0.1 – 6.0 %. При очистке этих газов можно получить концентрированный сероводород и переработать его в серную кислоту. Производство серной кислоты из сероводорода схематично можно представить следующими стадиями: Сжигание сероводорода в воздухе:
Н2S + 1.5O2 = SO2 + H2O + 519.3 кДж/ моль Окисление сернистого ангидрида на катализаторе в присутствии водяных паров, называемое «мокрым катализом»
2SO2 + O2 ® 2SO3 + 96.24 кДж/моль Конденсация полученной смеси SO3 и Н2О с образованием серной кислоты
SO3 г + Н2Ог = Н2SO4ж + 175. 2 кДж/моль Определить состав получаемого газа и теоретическое количество воздуха, необходимое для сжигания 1000 м3 сероводородного газа, в котором содержится 85% Н2S и 4% (об.) Н2О. Воздух содержит 1.5% (об.) Н2О. Решение. В 1000м3 сероводородного газа содержится 850 м3 Н2 S и 40 м3 Н2О. Определим количества, в м3: Кислорода, необходимого для полного сжигания сероводорода согласно реакции H2S + 1.5O2 = H2O + SO2 – (850 · 1.5 · 22.4)/22.4 = 1275 сухого воздуха – 1275/0.21 = 6071.5 влаги, поступившей с воздухом – (6071.5 · 1.5)/(100 – 1.5) = 92. В результате сжигания сероводорода образуется 850 м3 SO2 и 850 м3 Н2О. Получаемый газ содержит, м3: SO2…………..….…….…………………….. 850 H2O…………...……….……850 + 92 + 40 = 982 N2…………………….…6071/5 – 1275 = 4796.5 Общий объем газа 850 + 982 + 4796.5 = 6628.5м3 Состав газа, % (об.): SO2…………….…….………………...……12.8 H2O………………….…………………...…14.9 N2……………………..……………...……..72.3 Дальнейшая переработка газа, получаемого при сжигании сероводорода, возможна при наличии в нем кислорода. Поэтому сжигают сероводород в избытке воздуха. В газе, выходящем из печи должно быть 5–7 %(об.) О2, этого добиваются поддерживанием отношения объемов воздуха и сероводородного газа в пределах 9–10.
Пример 2. Простой суперфосфат. Производство простого суперфосфата состоит из следующих технологических этапов: Смешивание апатитового концентрата с серной кислотой, Вызревание суперфосфатной массы в камере, Складское дозирование камерного суперфосфата, Нейтрализация остаточной кислотности, гранулирование, сушка, Охлаждение, затаривание и отправка потребителю. Количество серной кислоты, рассчитанное по уравнениям реакций взаимодействия ее с составными частями фосфатного сырья в предположении, что реакции протекают полностью, называется стехиометрической нормой серной кислоты. Практическую норму с учетом применяемого избытка кислоты выражают в процентах от стехиометрической или в масс. частях серной кислоты на 100 масс. частей фосфата. Стехиометрическое количество серной кислоты, приходящееся на 1 масс.ч. Р2О5 апатита в соответствии с уравнением
Са5F(PO4)3 + 3.5H2SO4 = 3.5CaSO4 + 1.5Ca (H2 PO4)2 + HF составляет:
Стехиометрическую норму серной кислоты для разложения фосфоритов рассчитывают, используя следующие коэффициенты, отнесенные к 1 масс. ч., соответствующих окислов: .Р2О5…………….……1.61 Fe2O3 ………..………..0.61 CO2…………………...2.23 Al2O3…………………0.96 Расход серной кислоты с концентрацией а % Н2SO4 при норме ее n масс.ч. на 100 масс. ч. фосфата равен:
Gk = Количество воды, вводимое с серной кислотой GH2O, определяют следующим образом:
Вес суперфосфата, полученного из 100 масс, ч. фосфата равен:
Здесь х – масс, доля воды, испарившейся при смешении реагентов, схватывания пульпы и камерном вызревании, y – количество выделившегося в газовую фазу четырехфтористого кремния, масс.ч. По средним данным можно принять х = 0.25 и y = 1.7 (при содержании в фосфате 3.1 % фтора и улетучивании 40% его). Тогда: Gc = 100 + n + 0.75 (n/a·100-n) – 1.7 = 98.3 + 0.25n + 75n/a. Выход суперфосфата в масс. ч. на 1 масс. ч. фосфата:
Выход суперфосфата по аналитическим данным определяют по формуле
А = Сф/ Сс (1) где Сф и Сс – содержание общей Р2О5 в исходном фосфате и в полученном суперфосфате. За коэффициент разложения сырья К принимают отношение усвояемой части Р2О5 к общему содержанию Р2О5 в продукте (в%):
К = (С ус./Собщ.) · 100 (2) Количество фосфорной кислоты в виде Р2О5 (в масс. ч.), образовавшейся из 100 масс. ч. исходного фосфата G1 по окончании первой стадии реакции (после использования всей серной кислоты), вычисляют по формуле:
где n - норма серной кислоты Количество фосфорной кислоты в виде Р2О5, прореагировавшей во второй стадии, т. е, пошедшей на образование монокальцийфосфата (на 100 масс.ч фосфата) G2 определяют по формуле:
G2 =Сф· К/100 – 0,435n Количество Р2О5, связанной в образовавшемся монокальцийфосфате G3
G3 = 5/1.5G2 = 3.333G2. Степень нейтрализации первого иона водорода фосфорной кислоты Z (в%) вычисляют по формуле:
Z = 333.3 – 14500n/Cф· К. Пример 3. Апатитовый концентрат имеет следующий состав, %: Са3(РО4)2 …………...……….86 SiO2……………...…………1.11 Fe2O3…………….…………0.63 MgO…………….………….0.19 K2O………………..……….0.23 Na2O……………….………0.63 CaF2………………………………6.20 влага……………………….……..0.35 Al2O3…………………….………..0.90 нерастворимый в кислоте остаток……………………….…..3.96 Подсчитать расход серной кислоты (моногидрата) и количество воды (без учета гигроскопической влаги), необходимое для разложения 100кг апатитового концентрата, если коэффициент разложения всех его составных частей равен 95%. Решение Из 100кг апатита при степени разложения 95% прореагирует, кг: Ca3 (PO4) 2…...…………….81.7 Na2O……………………….0.60 CaF2…………..……………5.89 K2O……………...…………0.22 Fe2O3……………….……………..0.60 MgO…………………...………….0.18 Al2O3……………...………………0.86 Необходимое количество серной кислоты хк и воды yB для разложения составных частей апатита - х1, х2,…… и y1. y2. … подсчитываем по уравнениям:
1) Ca3(PO4) 2 + 2H2SO4 + H2O = x1 = (81.7 · 196)/310 = 51.66 =Ca (H2PO4)2·H2O + 2CaSO4 y1= (81.7 · 18)/310 = 4.74
2) CaF2 + H2SO4 = CaSO4 + 2HF x2 = (5.89 · 98)/78 = 7.40
3) Fe2O3 +3H2SO4 +6H2O = x3 = (0.6 · 294)/ 160 = 1.10 =Fe2(SO4)3 · 9H2O y3 = (0.6 · 6 · 18)/160 = 0.40
4) Al2O3 + 3H2SO4 + 15H2O = x4 = 2.48 =Al2(SO4)3·18H2O y4 = 2.28
5) MgO + H2SO4 = MgSO4 ·H2O x5 = 0.44 y5 = 0 6) K2O + H2SO4 = K2SO4 + H2O x6 = 0.23 y6 = -0.042 7) Na2O + H2SO4 = Na2SO4 + H2O x7 = 0.95 y7 = -0.17
Количество воды, выделяющейся при образовании SiF4 по реакции:
4HF + SiO2 = SiF4 + 2H2O, 1.1· 18 · 2 /60 = 0.66. Суммируя количества моногидрата серной кислоты и воды, получим, что для разложения 100 кг апатита требуется, кг:
хк = 51.66 + 7.40 + 1.10 + 2.48 + 0.44 + 0.23 + 0.95 = 64.26 yB = имер 3. n + 0.75 (n/a*68 масс. 4.74 + 0.40 + 2.28 + 0.66 – (0.042 + 0.174) = 7.86 На практике применяют более высокую норму моногидрата серной кислоты на 100 кг апатита, равную 68–72 кг. При концентрации кислоты 67–8% с ней вводится 32–35 кг воды на 100 кг апатита, которая требуется не только для образования кристаллогидратов, но и для создания определенной среды.
|

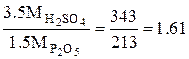 масс. ч.
масс. ч.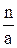 · 100масс.ч.
· 100масс.ч.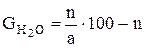
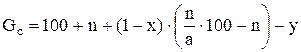
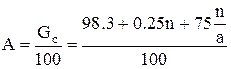
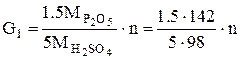 = 0.435n масс.ч.,
= 0.435n масс.ч.,


