Свойства разбавленных растворов электролитов.Растворы электролитов обладают такими же свойствами, что и растворы неэлекторлитов. Однако, в растворе электролита доля связанного растворителя выше, чем в растворе неэлектролита той же концентрации, а так же реальное число молей растворенных частиц больше числа молей его молекул, вследствие их диссоциации. Поэтому различия между свойствами чистого растворителя и раствора электролита выражены сильнее. Следовательно, в случае растворов электролита необходимо это учитывать. Вследствие этого, в формулы расчета осмотического давления, давления насыщенного пара, изменения температур кристаллизации и кипения вводится поправочный коэффициент i, который называют изотоническим коэффициентом или коэффициентом Вант -Гоффа. Этот коэффициент учитывает увеличение числа частиц из-за диссоциации: i= 1 + a×(k-1) (13) или a = (i-1)/(k-1) (14), где a - степень диссоциации, k- число ионов, на которые распадается при диссоциации молекула электролита. Например, А12(SО4)3Û2А13+ + 3SО42-, всего 5 частиц (2 частицы А13+ и 3 частицы SО42-). С учетом изотонического коэффициента законы Рауля (формулы 4, 7,10) и Вант – Гоффа (формула 5) приобретают вид:
где р0–давление насыщенного пара над чистым растворителем,(кПа или Па) n2 – количество растворенного вещества, (моль) n 1 – количество вещества растворителя, (моль) i – изотонический коэффициент. росм. = R×Т×Сm× i (16), где R – универсальная газовая постоянная, (Дж/моль К) Т- температура (К), См – молярная концентрация растворенного вещества, (моль/л) i – изотонический коэффициент. Dtкрист = i ×К ×Сm (17), где Сm – моляльная концентрация растворенного вещества, (моль/кг) К – криоскопическая константа растворителя, i – изотонический коэффициент. Dtкип = i ×Е ×Сm (18), где Сm – моляльная концентрация растворенного вещества, (моль/кг) Е – эбуллиоскопическая константа растворителя, i – изотонический коэффициент. Зная осмотическое давление или температуру кристаллизации и т.д. всегда можно вычислить степень диссоциации вещества в растворе. При этом для сильных электролитов это ''кажущаяся'' степень диссоциации, поскольку в растворах сильные электролиты диссоциированы практически нацело. Пример 5: Кажущаяся степень диссоциации соли в 3,2%-ном водном растворе КС1 составляет 0,68. Вычислить температуру кипения раствора. Решение: Данная смесь – раствор электролита. Для него Dtкип = i Е Сm. i= 1 + a×(k-1) Данная соль диссоциирует на две частицы: КС1 Û К+ + С1-, следовательно, К = 2. i = 1 + 0,68 ×(2-1) =1,68. Найдем моляльную концентрацию по формуле (9): Сm = mраств. вещества ×1000/ М раств. вещества ×m расвторителя . В 100 г 3,2%-ного раствора КС1 содержится 3,2 г КС1 и 96,8 г воды. МКС1 = 39 + 35,5 = 74,5 г/моль. Сm = 3,2 ×1000 /74,5 ×96,8 = 0,44 моль/кг. Найдем повышение температуры кипения раствора, Е(Н2О) = 0,52. Dtкип = i× Е ×Сm = 1,68× 0,52 ×0,44 = 0,380С. Найдем температуру кипения раствора, tкип(Н2О) = 1000С tкип. р-ра = tкип. р-ля + Dtкип = 100 + 0,38 = 100,380С. ОТВЕТ: температура кипения раствора 100,380С. Пример 6: Давление пара раствора, приготовленного из 0,408 молей Са(NО3)2 и 1000 г воды, равно 99,56 кПа при 1000С. При какой температуре давление пара достигнет 101,3 кПа и раствор закипит? Решение: 1) Для раствора электролита Найдем изотонический коэффициент: Dр = рр-ля - рр-ра. При 1000С Dр = 101,3 – 99,56 = 1,74 кПа.
2) Найдем повышение температуры кипения раствора, для воды Е = 0,52: Dtкип = i ×Е ×Сm Т. к. в 1 кг воды растворено 0,408 моля Са(NО3)2, то моляльная концентрация раствора равна 0,408 моль/кг. Dtкип =2,384 ×0,52 ×0,408 = 0,5060С. 3) Найдем температуру кипения раствора, tкип(Н2О) = 1000С: tкип. р-ра = tкип. р-ля + Dtкип =100 + 0,506 = 100,560С. ОТВЕТ: раствор закипит при 100,560С. Пример 7: Раствор, содержащий 0,85 г хлорида цинка в 125г воды, кристаллизуется при –0,230С. Определить кажущуюся степень диссоциации ZnС12. Решение: 1) Найдем моляльную концентрацию раствора хлорида цинка, М(ZnС12) =136,3 г/моль: Сm=mраств.вещ 1000/Мраств вещ×mр-ля=0,85×1000/(136,3× 125)=0,05кг/моль 2) Найдем изменение температуры замерзания раствора tкрист (Н2О) – 00С: Dtкрист. =tкрист. р-ля – tкрист. р-ра =0 –(-0,23) =0,230С. 3) Найдем изотонический коэффициент: i=Dtкрист/Сm ×К=0,23/0,05× 1,86=2,47 4)Найдем кажущуюся степень диссоциации соли по уравнению: a=(i-1)/(k-1). Электролит диссоциирует ZnС12Û Zn2+ + 2С1- на 3 частицы (один ион Zn2+ и два иона С1-), следовательно k = 3, тогда: a = (2,47 – 1)/ (3 – 1) = 0,735. Ответ: Кажущаяся степень диссоциации хлорида цинка в данном растворе составляет 0,735.
|

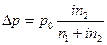 (15),
(15),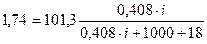 ; i =2,384.
; i =2,384.


