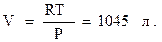Фазовые превращения однокомпонентных системРассмотрим превращение вещества, состоящего из одного химического компонента, например, воды. Температура под поршнем остается постоянной. Пусть одна грамм-молекула воды находится в цилиндре под поршнем при температуре 20°C и давлении 1 атм. Выдвигая поршень, уменьшаем давление под ним. При этом жидкость будет испаряться и под поршнем образуется пар. При длительной остановке поршня, давление уравновесится. Это давление пара, находящегося в равновесии с жидкостью, называется упругостью пара. Для воды при t=20°C упругость Р = 17,4 мм.рт.ст. Если считать пар идеальным газом, то объем этого пара:
Таким образом, при достижении под поршнем объема 1045 л все 18 г воды перейдут в газообразное состояние. Упругость пара вещества заданного состава зависит только от температуры:
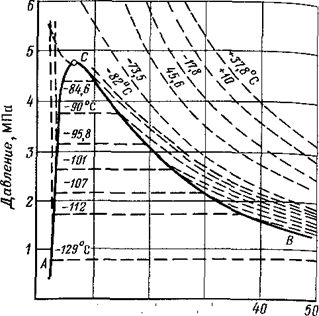
Индивидуальные углеводороды в зависимости от давлениях и температуры могут находиться в разных фазовых состояниях: парообразном (газовом), жидком или твердом. Возможно также, что одна его часть находится в жидком (или твердом) состоянии, а другая — в газообразном. Фазовое состояние однокомпонентного вещества (метана, например) можно выразить диаграммой PV, где V – удельный объем (на 1 моль или на 1 кг), Р - давление – изотермы состояния (рис.2.3.1). Такие изотермы могут быть построены, исходя из уравнения Ван-дер-Ваальса или по результатам эксперимента. В первом случае при построении изотерм придется исключить волнообразные участки кривых в двухфазной области, описывающих метастабильные состояния для каждого конкретного вещества (уравнение является полиномом третьей степени с действительными коэффициентами и, следовательно, в некоторой области должно иметь три действительных корня).
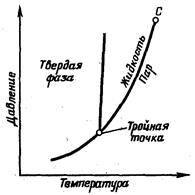
Удельный объем, см3/г Рис.2.3.1. Фазовая диаграмма метана. По фазовой диаграмме можно определить в каком фазовом состоянии будет находиться вещество при тех или иных значениях температуры, давления и объема: участок слева от кривой АСВ соответствует жидкому состоянию, справа от нее вещество находится в парообразном состоянии. Ниже, под кривой АСВ вещество находится в переходном двухфазном состоянии. Каждая пунктирная кривая отражает изменение фазового состояния вещества при данной температуре, причем в двухфазной области ее участок строго параллелен оси абсцисс, что говорит о постоянстве давления фазового перехода. Участок кривой АС называется кривой точек парообразования (кипения), СВ – кривая точек конденсации (точек росы). Как видно из диаграммы, чем выше температура, тем уже отрезок кривой, приходящийся на двухфазную область. Наконец при некоторой температуре (для каждого индивидуального вещества своей) это участок переходит в точку С, выше которой система может находиться только в парообразном (газовом) состоянии, как бы ни было велико давление. Эта точка на фазовой диаграмме называется критической, также критическими называются соответствующие ей температура и давление. Итак, критической точкой называется такая точка на фазовой диаграмме, ниже которой вещество не может быть переведено в двухфазную область никаким другим способом, кроме понижения температуры. Обе фазы (жидкость и пар) при данной температуре существуют только в том случае, если давление равно упругости насыщенного пара этой жидкости (ветвь ВС на кривой АВС диаграммы). Фазовые превращения вещества можно также изобразить в виде фазовой диаграммы в координатах РТ (рис.2.3.2.). На такой диаграмме строят зависимость давления от температуры для некоторого постоянного удельного объема вещества в широком диапазоне давлений и температур. При этом состояние вещества меняется от твердого до газообразного. Точка, в которой возможно одновременное нахождение вещества во всех трех состояниях, называется Тройной точкой. Кривая, соединяющая Тройную точку и Критическую, является одновременно кривой точек кипения и конденсации – кривой давления насыщенного пара. Кривая, разделяющая область твердого и жидкого состояния вещества – кривая точек плавления и затвердевания (кристаллизации), ниже Тройной точки – кривая возгонки (сублимации).
Рис. 2.3.2. Фазовая диаграмма
|