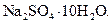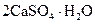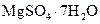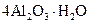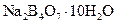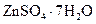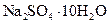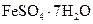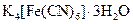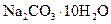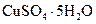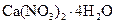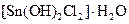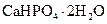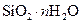Самые известные кристаллогидратыОбщие положения Растворы занимают промежуточное место между химическими соединениями и механическими смесями. Однородность растворов делает их схожими с химическими соединениями, также на химическое взаимодействие между компонентами растворов указывает выделение теплоты при растворении некоторых веществ. Еще одним доказательством того, что компоненты раствора химически взаимодействуют друг с другом, служит тот факт, что многие вещества выделяются из водных растворов в виде кристаллов, содержащих кристаллизованную воду – гидратов; причем на каждую молекулу растворенного вещества приходится определенное число молекул воды. Как правило, гидраты – нестойкие соединения, во многих случаях они разлагаются уже при выпаривании растворов. Но иногда гидраты так прочны, что при выделении растворенного вещества из раствора вода входит в состав его кристаллов. Вещества, в состав которых входят молекулы воды называются кристаллогидратами, а содержащаяся в них вода – кристаллизационной. Состав кристаллогидратов принято изображать формулами, показывающими, какое количество кристаллизованной воды содержит кристаллогидрат. Например, кристаллогидрат сульфата натрия, содержащий на один моль сульфата натрия десять молей воды выражается формулой В нашей жизни получили широкое распространение тривиальные названия веществ. В таблице 1 приведены наиболее часто встречающиеся формулы кристаллогидратов, их тривиальные названия и названия по систематической номенклатуре, рекомендованной ИЮПАК. Таблица 1 Самые известные кристаллогидраты
Растворы отличаются от химических соединений тем, что состав взаимодействующих веществ может изменяться в широких пределах. В свойствах раствора можно обнаружить многие свойства компонентов его составляющих, что характерно для механических соединений. Исходя из всего вышесказанного, можно дать следующее определение раствора. Раствор – однородная многокомпонентная система, состоящая из растворителя, растворённых веществ и продуктов их взаимодействия, относительные количества которых могут изменяться в широких пределах. Существует несколько способов классификации растворов. I. По агрегатному состоянию: 1. Жидкие (морская вода) 2. Газообразные (воздух) 3. Твёрдые (многие сплавы металлов) В химической практике наиболее важны растворы, приготовленные на основе жидкого растворителя. Именно жидкие однородные смеси в химии называют просто растворами. Наиболее широко применяемым неорганическим растворителем является вода. Растворы с другими растворителями называются неводными. II. По размеру частиц растворенного вещества: 1. Истинные (размер частиц менее 1·10−9 м) Растворенное вещество диспергировано до атомного или молекулярного уровня, частицы растворенного вещества не видимы ни визуально, ни под микроскопом, свободно передвигаются в среде растворителя. Истинные растворы – термодинамически устойчивые системы, неограниченно стабильные во времени. 2. Коллоидные (размер частиц 1·10−9 м — 5·10−7 м) Частицы в таких растворах можно обнаружить при помощи ультрамикроскопа III. С точки зрения термодинамики: 1. Идеальный Внутренняя энергия каждого компонента не зависит от концентрации. Компоненты раствора смешиваются, как идеальные газы; предполагается, что сил взаимодействия между частицами нет, и вещества смешиваются без выделения или поглощения теплоты. 2. Неидеальный (реальный) Растворы, не удовлетворяющие условиям идеальных растворов, относят к реальным. Чем меньше концентрация раствора, тем ближе он к идеальному раствору. IV. По величине электрической проводимости: 1.Электролитический (проводит электрический ток) 2. Неэлектролитический (электрический ток не проводит) V. По количеству растворенного в нем вещества: 1. Насыщенный раствор – раствор, который находится в динамическом равновесии с избытком растворённого вещества, то есть молекулярные или ионные частицы, распределённые в жидком растворе, присутствуют в нём в таком количестве, что при данных условиях не происходит дальнейшего растворения вещества. Насыщенный раствор является стабильной системой, т.е. может существовать при данной температуре без изменения сколько угодно долго. Пример: если поместить 50 г NaCl в 100 г H2O, то при 20 ºC растворится только 36 г соли. 2. Ненасыщенный раствор – раствор, содержащий меньше вещества, чем необходимо для насыщения. Пример: если поместить в 100 г воды при 20 ºC менее 36 г NaCl. 3. Перенасыщенный раствор – раствор, в котором при данной температуре находится в растворенном состоянии больше вещества, чем в его насыщенном растворе при тех же условиях. Пример: При нагревании смеси соли с водой до 100 ○C произойдёт растворение 39,8 г NaCl в 100 г воды. Если теперь удалить из раствора нерастворившуюся соль, а раствор осторожно охладить до 20 ºC, избыточное количество соли не всегда выпадает в осадок. В этом случае мы имеем дело с перенасыщенным раствором. Такие растворы очень неустойчивы. Помешивание, встряхивание, добавление крупинок соли может вызвать кристаллизацию избытка соли и переход в насыщенное устойчивое состояние. Любой раствор состоит из растворителя и растворенного вещества. В случае растворов газов или твердых веществ в жидкостях растворителем обычно считается жидкость, а растворенным веществом – растворенный газ или твердое вещество, независимо от их относительного количественного содержания. Когда компоненты обладают ограниченной смешиваемостью, то растворителем является тот, прибавление которого к раствору возможно в неограниченном количестве без нарушения гомогенности. Если компоненты обладают неограниченной растворимостью, то можно выделить два случая. При значительном различии содержания компонентов растворителем считается вещество, присутствующее в относительно большем количестве. Понятия растворитель и растворенное вещество теряют смысл, когда речь идет о смесях с примерно равными или близкими концентрациями компонентов. Содержание растворенного вещества в растворе может быть выражено либо безразмерными единицами – долями или процентами, либо величинами размерными – концентрациями. Концентрацией раствора называют содержание растворенного вещества в единице объема или массы раствора или растворителя. Растворы, содержащие растворенное вещество в количестве, соизмеримом с количеством растворителя, называют концентрированными. Растворы с малой концентрацией растворенного вещества, называют разбавленными. Граница между концентрированными и разбавленными растворами условна. В химии используют более десятка способов выражения концентрации. Ниже в таблице 2 приведены наиболее часто употребляемые на практике способы выражения содержания растворенного вещества в растворе.
|