Масообміні технологічні процеси.До них відносяться 1. абсорбція – вибіркове поглинання газів (парів) із газової суміші рідким асорбентом; 2. адсорбція – поглинання газів парів, або розчинених у рідині речовин поверхнею пористого твердого поглинача; 3. ректифікація – часткове або повне розділення гомогенних рідких сумішей на компоненти в результаті різниці їх якостей; 4. сушіння – виділення вологи з твердих матеріалів за рахунок випарювання; 5. екстракція – витяжка речовини розчиненої у рідині іншою рідиною, яка практично не змішується; 6. екстрагування – витяжка речовини з твердого пористого матеріалу за допомогою розчинника; 7. кристалізація – виділення твердої дози у вигляді кристалів з пористих розчинників або розплавів. 8. Розчинення – перехід твердої дози у рідину за рахунок розчинника. Масообмін можливий лише за наявності нерівноважності фаз. Цільовий компонент переходить з фази, де його вміст вищий у фазу, у якій його вміст нижчий рівноважного. Чим більшим є відхилення від стану рівноваги, тим інтенсивніше йде процес масопередача. Перенос речовини всередині фази може проходити шляхом молекулярної реакції якщо середовище нерухоме, або через конвекцію і молекулярну реакцію одночасно якщо перенос відбувається у рухомому середовищі. Основним рівнянням молекулярної функції є перший закон Фіка:
де М – маса речовини, яка профільтрована за час t через поверхню S, Кнвективна дифузія – це дифузія у рухомому середовищі. Закон конвективної дифузії дозволяє визначити кількість речовини, яка переноситься із однієї фази до межі другої
Абсорбція поділяється на фізичну абсорбцію і хемосорбцію. При фізичній абсорбції поглинаючий компонент не вступає у взаємодію з абсорбентом. Такий процес збільшеного зворотній. Хемосорбція передбачає хімічне з'єднання цільового компонента з абсорбентом, у результаті якого створюється нова речовина. Процес абсорбції завжди супроводжується виділенням теплоти. Розчинність газів у абсорбентах залежить від фізичних та хімічних властивостях газів та їх рідинної фаз. Температури а також тиску газу. Розглядаючи процес абсорбції як об’єкт керування. Можна відмінити для неї чотири вихідні регулюючі параметри: концентрацію продукту у насиченому абсорбенті або у абсорбційному газі, температуру, тиск та рівень абсорбенту у нижній частині абсорбера. Рівень абсорбенту в апараті є необхідним для забезпечення його залежно матеріального балансу. Тиск у абсорбері відіграє важливу роль, оскільки згідно закону Генрі розчинність газу у рідині збільшується з підвищенням тиску і зниженням температури. Вихідним параметром абсорбера є: витрати газової суміші, абсорбенту, насиченого абсорбенту з частини апарата і абсорбційного газу, а також витрати холодоносія рис. 3.1.
Рис. 3.1. Структурна схема абсорбера як об'єкта керування. Рівняння матеріального балансу має вигляд:
З рівняння виходить, що кількість цільового продукту, перенесеного з газової фази за одиницю часу становить:
а концентрація цільового продукту у обсязі:
Ступінь вилучення цільового продукту з газової фази
На витрати абсорбенту впливають температура і тиск за яких відбувається процес. Якщо рівняння вагової залежності описується рівнянням Генрі у вигляді
У промисловій практиці витрати у абсорбенті
Абсорбцію застосовують у хімічній промисловості в процесі очищення і висушування газів, очищення розчинів, розділення газів і парів. Процеси абсорбції тісно пов’язані з процесами десорбції. Залежно від природи сил, що діють на поверхню твердого тіла, розділяють фізичну абсорбцію і хемосорбцію. Рівно важність при абсорбції характеризується залежностями кількості речовини, яка поглинається одиницею маси або об’єму одного абсорбенту від температури і масової концентрації поглинаючої речовини у паро газовій суміші або розчині. Залежність між рівноважними концентраціями фаз під час абсорбції
Рис. 3.2. Структурна схема абсорбера як об’єкта керування Вихідні параметри такі: витрати газової суміші, витрати сорбенту. Якщо він подається безпосередньо; витрати абсорбційного газу, які впливають на тиск газу у абсорбері, витрати теплоносія, якщо процес протікає за умови підвищених температур. Процес абсорбції завжди супроводжується зростанням температури, у цьому разі використовують залежність абсорбційної властивості від тиску. Процес фізичної адсорбції описується рівнянням Ленгмюра
Ректифікація – це процес протитечійної взаємодії двох неврівноважених фаз рідини і пари, яка випаровується за цієї рідини. При цьому пара постійно збагачується компонентом, а рідина високо киплячим. Процеси ректифікації реалізуються періодично або безперервно; під тиском, вакуумом або при атмосферному тиску. Свіжий розчин підігріється до температури кипіння і подається на верхню тарілку вичерпної частини колони. Флегма надходить на верхню тарілку закріпляючої частини колони і стікає під тарілкою в колону, взаємодіючи з парою яка піднімається до вичерпної (нижньої) частини. Важкі компоненти накопичуються у кубі колони. Частина якого відводиться у вигляді кубового замінника. Друга частина нагрівається до температури кипіння у внутрішньому або виносному кип’ятильнику, створюючи рушійну силу у нижній частині колони. Матеріальний баланс усієї ректифікаційної колони для витрат має вигляд
а для легкого компонента
Ректифікаційну колону, як об’єкт управління, умовно можна розділити на дві частини: нижню (вичерпну) і верхню (закріпляючу). Верхня частина колони характеризується подальшими параметрами: концентрація цільового компонента, температура Т1і тиск пари Р рис. 3.3.
а) б) Рис. 3.3. Структурні схеми ректифікаційної колони як об’єкта керування: закріпляючої та вичерпної частини. Вихідними параметрами можуть бути витрати флегми пари дистиляту і пари вичерпної частини. Останній параметр не відноситься до регулюючих. Матеріальний баланс витрат для верхньої частини має вигляд
а для легколеткого компонента
де Qp, Qg, Qk – концентрації цільового компонента у свіжому розчині, дистиляті і у кубовому залишку. Ректифікаційну колону, як об’єкт керування, можна розділити на дві частини: нижню (вичерпну) і верхню (закріплюючу). Верхня частина колони характеризується подальшими вихідними параметрами: концентрація цільового компонента Q, температура Т1, тиск випару Р, рис. 3.3. Вихідними параметрами можуть бути витрати флегми Fф, пари дистиляту Fд і випару вичерпної вичерпної частини Fn. Останній параметр не відноситься до регулюючих. Матеріальний баланс витрат для верхньої частини має вигляд: Fn = Fф + Fg, (3.15) а за цільовою речовиною
де Для нижньої частини колони
а за легколеткою речовиною
Рівняння теплового балансу для колони має вигляд:
де: qт – теплота, що надходить з випаром до кип’ятильника; qр – теплота, що надходить до колони з свіжим розчином; qд – теплота, що витрачається з парою через закріплюючу частину колони; qД - теплота, що витрачається з дистилятом; qк – теплота, що відходить з кубовим залишком; qвт – втрати теплоти у навколишнє середовище. Витрати граючої пари на обігрів куба - випарювача можна знайти з рівняння:
де rт – питома теплота конденсації (пароутворення) граючої пари; x – ступінь сухості граючої пари. Витрати води на конденсацію випару цільового компоненту у дефлегматорі становлять
де cx – питома теплоємність води; Тп, Тк – початкова та кінцева температури води; R – флегмове число. Теплота, що переноситься дистиллятом, становить:
де IД – ентальпія дистиляту. Теплота свіжого розчину становить:
де Ір – ентальпія свіжого розчину. Теплота, яка витрачається з кубовим залишком, становить:
де Ік – ентальпія кубового залишку. Якщо теплообмін проходить без зміни агрегатного стану теплоносія, то ентальпія становитиме:
де с – питома теплоємність теплоносія; Т – його температура. Вичерпна частина колони має чотири вихідних параметри: концентрація цільового продукту Q; температура кипіння Т; тиск Р та рівень L рідини у кубовій частині, рис. 3.3. б. До вхідних параметрів відносяться витрати: свіжого розчину Fр, теплоносія Fт, пари цільового продукту Fn і кубового залишку Fk. Витрати Fn у колоні є регулюючим параметром. Витрата пари цільового продукту становить
де ср, Тр – питома теплоємність і температура свіжого розчину; ІД – ентальпія дистилята; Тк – температура кипіння у кубі колони. Сушіння матеріалів розділяється на: 1) контактну - теплота від теплоносія передається до матеріалу через розподільчу стінку; 2) конвективну – теплота передається при безпосередньому зіткненні з сушильним матеріалом; 3) радіаційну – теплота передається інфрачервоним випромінюванням; 4) діелектричну – теплота виділяється під дією струмів високої частоти; 5) сублімаційну – матеріал висушується у замороженому стані за умови глибокого вакууму. Найпоширеніша у промисловості є перші три види сушіння. Як об’єкти керування сушильний апарат має два вихідні параметри: 1) концентрація вологості у сухому матеріалі; 2) температура сушіння (рис. 3.4)
Рис. 3.4. Структурна схема сушильного апарата як об'єкта керування. Вихідними параметрами є витрати мокрого матеріалу і теплоносія. Під час контактного матеріалу до початкової температури сушіння і на сам процес сушіння. Витрати теплоти на нагрівання матеріалу.
де Мс – кількість висушеного матеріалу СМ – питома теплоємність висушеного матеріалу; Тн,Тп – температура сушіння і початкова температура матеріалу, який надходить на сушіння. Тільки на сушіння витрати теплоти становить
Кількість вологого матеріалу, що надходить на сушку.
Загальна кількість теплоти, передбаченої для сушіння матеріалу
Наприкінці витрати теплоти у навколишнє середовище становить 5-10% від її загальної кількості. Для конвективного сушіння використовується гаряче повітря або теплові гази. Гарячий газ виконує функції тепло і волого носія. Скільки вміст парів у газі характеризується парціальним тиском, то відносна вологість повітря Рівняння для вмісту вологи у газі має вигляд.
Якщо сушіння здійснюється гарячим повітрям, то
Оскільки Рmax=f(t) то вміст вологи mn є одиницею відносної вологості Часто для моделювання процесу сушіння необхідною є ентальпія вологого повітря.
Рівняння матеріального балансу конвективного апарата щодо витрат має вигляд
де Кількість висушеного матеріалу становить:
де З цього рівняння відносна вологість сухого матеріалу становитиме
Рівняння матеріального балансу сушильного апарата за вологістю буде:
де Кількість випареної води з мокрого матеріалу
де Кількість теплоти, що витрачена на нагрів повітря у калорифері.
де
4. Хімічні процеси
Ці процеси відбуваються у спеціальних апаратах які називаються хімічними реакторами і передбачають, що в них відбуваються хімічна реакція між двома або більше речовинами. Хімічні процеси класифікуються такими ознаками: 1) тип механізму хімічного перетворення; 2) Термічні умови; 3) агрегатний (фазовий) стан реагентів; 4) кількість каталізатора. Обчислювальні формули для визначення ступінчатого перетворення у хімічному процесі мають різний вигляд, залежно від механізму хімічної реакції і типу реакції якому вона виникла. Наприклад ступінь перетворення для зворотної реакції першого порядку у реакторі ідеального витіснення.
Для реактора ідеального змішування.
Якщо реакція незворотна першого порядку, то
У процесах хімічного перетворення речовини, часто хімічні реакції супроводжуються температурним обміном, переносом маси (дифузія), гідродинамічними процесами. Ці фізичні явища за певних умов можуть значно впливати на швидкість хімічного перетворення речовини. Як правило ці фактори характеризуються температурою Т, тиском Р, концентрацією Q вихідних речовин. Відомо, що хімічні процеси завжди супроводжуються виділенням або поглинанням теплоти. Тепловий ефект процесу в деяких випадкових може спричинити значні змінні температури реакційного об’єму реактора ця змінна впливає на умови рівноваги хімічного процесу, його швидкість, ступінь перетворення речовини і склад продуктів реакції. Швидкість хімічних процесів К сильно залежить від зміни температури. Ця залежність виражається рівнянням Аррніуса:
де Важливим фактором, що впливає на швидкість хімічних процесів, є тиск. Його змінна впливає на зміщення хімічної рівноваги, і ступінь перетворення вихідної рівноваги, В загальному випадку швидкість реакції буде:
де Тобто для реакції першого порядку тиск не впливає на швидкість реакції, для реакцій другого порядку – швидкість реакції пропорційна тиску. Тобто процес хімічного перетворення, як об'єкт керування, може мати 3 вихідні параметри: 1) Концентрацію цільової речовини; 2) температури; 3) тиск (для неперервних рідинних реакторів є четвертий параметр – рівень рідини у реакторі). Структурні схеми реакторів подані на рис. 4.1.
а) б)
Рис.4.1. Структурна схема реакторів як об'єктів керування: рідинного (а) та газового (б) неперервної дії. Вихідними параметрами є: витрати регулюючих потоків F1…Fn; витрати холодоносія (або теплоносія); витрати готового продукту із реактора (для реакторів неперервної дії). Реактори періодичної дії характеризуються тим що регулюючі речовини спочатку завантажуються, а тоді створюються умови для протікання реакції (наприклад за рахунок нагрівання реагуючої маси), причому протягом всього часу реагуюча маса залишається у реакторі. Для такого реактора як об'єкта керування вихідними параметрами будуть: концентрація продукту реакції і температура, а вихідними тільки витрати теплоносія
Рис. 4.2. Структурні схеми реакторів як об'єктів керування: періодичної та напівперіодичної дії. Для реакторів напів періодичної дії характерним є постійне або періодичне додавання до реакційної маси одного з реагентів каталізатора. Витрати цих речовин. Як правило достатньо малі і суттєво не впливають на рівень реакційної маси. Величина витрат, яка зводится в реактор, залежить від концентрації, або від температури. Аналізуючи роботу реактора часто користуються рівняннями матеріального балансу по одному з вихідних речовин:
Для реактора неперервної дії за умов сталого потоку реагуючих речовин рівняння математичного балансу матиме вигляд:
а для реактора передаточної дії Тепловий баланс процесу хімічного перетворення складають на основі закону зберігання енергії (теплоти). У загальному вигляді рівняння йього балансу буде:
|

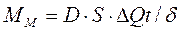 (3.1)
(3.1)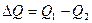 - змінна концентрації речовини.
- змінна концентрації речовини. . (3.2)
. (3.2)
 . (3.3)
. (3.3)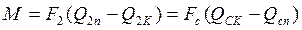 , (3.4)
, (3.4)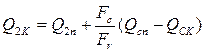 . (3.5)
. (3.5)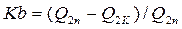 . (3.6)
. (3.6)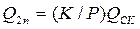 то
то 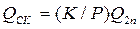 і мінімальні витрати абсорбенту становлять:
і мінімальні витрати абсорбенту становлять: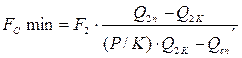 . (3.7)
. (3.7)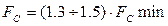 . (3.8)
. (3.8) або
або  при T=const називається ізотермічними адсорбції. То процес абсорбції як об’єкт керування має такі вихідні параметри: концентрація цільового компонента Q у газовій суміші або рідині на виході апарата температура процесу та тиск газової суміші рис. 3.2.
при T=const називається ізотермічними адсорбції. То процес абсорбції як об’єкт керування має такі вихідні параметри: концентрація цільового компонента Q у газовій суміші або рідині на виході апарата температура процесу та тиск газової суміші рис. 3.2.
 , (3.9)
, (3.9) . (3.10)
. (3.10) , (3.11)
, (3.11) . (3.12)
. (3.12)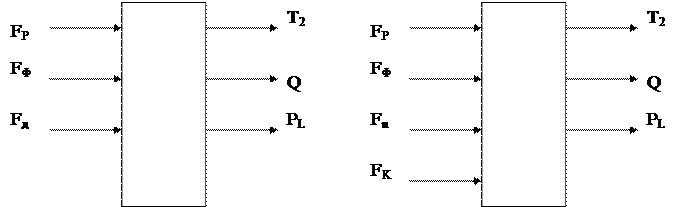
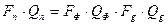 , (3.13)
, (3.13)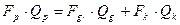 , (3.14)
, (3.14)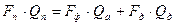 , (3.16)
, (3.16)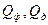 - концентрація цільової речовини у флегмі за висотою колони і в дистиляті.
- концентрація цільової речовини у флегмі за висотою колони і в дистиляті.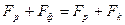 , (3.17)
, (3.17)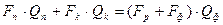 . (3.18)
. (3.18)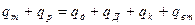 , (3.19)
, (3.19)
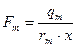 , (3.20)
, (3.20) , (3.21)
, (3.21) , (3.22)
, (3.22)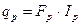 , (3.23)
, (3.23)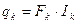 , (3.24)
, (3.24) , (3.25)
, (3.25)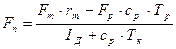 , (3.26)
, (3.26)
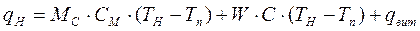 , (3.27)
, (3.27) . (3.28)
. (3.28) . (3.29)
. (3.29)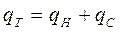 . (3.30)
. (3.30) .
.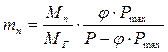 . (3.31)
. (3.31)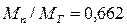
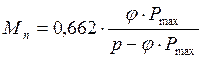 . (3.32)
. (3.32) і температури сушіння Т.
і температури сушіння Т. . (3.33)
. (3.33) , (3.34)
, (3.34)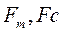 масові витрати вологого і сухого матеріалу,
масові витрати вологого і сухого матеріалу,  - витрати вологи
- витрати вологи , (3.35)
, (3.35) - відносні вологості мокрого і висушеного матеріалу.
- відносні вологості мокрого і висушеного матеріалу. . (3.36)
. (3.36) , (3.37)
, (3.37)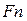 витрати абсолютного сухого повітря
витрати абсолютного сухого повітря 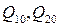 - відносна вологість повітря відповідного до входу в сушильний апарат і на його виході.
- відносна вологість повітря відповідного до входу в сушильний апарат і на його виході.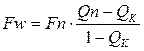 Рівняння теплового балансу конвективного сушильного агрегату:
Рівняння теплового балансу конвективного сушильного агрегату: , (3.38)
, (3.38)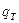 теплота, що відводиться до калорифера;
теплота, що відводиться до калорифера; 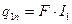 - теплота, що надходить з повітрям до калорифера;
- теплота, що надходить з повітрям до калорифера;  - теплота, що надходить до апарату з вологим матеріалом;
- теплота, що надходить до апарату з вологим матеріалом;  - теплота, що надходить з вологою, випареною з матеріалу;
- теплота, що надходить з вологою, випареною з матеріалу;  - теплота, що надходить з транспортним пристроєм, що виходить з апарата.
- теплота, що надходить з транспортним пристроєм, що виходить з апарата.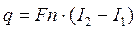 , (3.39)
, (3.39) - витрати повітря;
- витрати повітря; 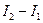 - ентропія повітря на вході і виході калорифера.
- ентропія повітря на вході і виході калорифера.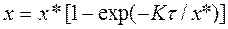 . (4.1)
. (4.1) . (4.2)
. (4.2) . (4.3)
. (4.3)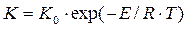 , (4.4)
, (4.4) - стала для даного типу реакції і даних умов; Е – енергія активації реакції; R – універсальна часова стала.
- стала для даного типу реакції і даних умов; Е – енергія активації реакції; R – універсальна часова стала.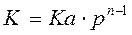 , (4.5)
, (4.5) - швидкість реакції за атмосферним тиском; n – порядок реакції.
- швидкість реакції за атмосферним тиском; n – порядок реакції.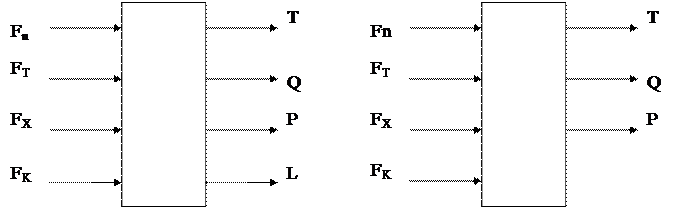

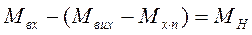 . (4.6)
. (4.6) , (4.7)
, (4.7)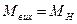 .
.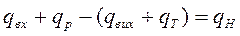 . (4.8)
. (4.8)


