Основные положения метода валентных связей- Ковалентная химическая связь образуется двумя электронами с противоположно направленными спинами, принадлежащими двум атомам. - Ковалентная связь тем прочнее, чем в большей степени перекрываются взаимодействующие электронные облака. - Характеристики химической связи определяются типом (s, p, d) атомных орбиталей (АО). - Ковалентная связь направлена в сторону максимального перекрывания АО реагирующих атомов. Обобществление электронной пары осуществляется либо по обменному механизму, когда каждый из взаимодействующих атомов поставляет по одному электрону для связи, либо по донорно-акцепторному механизму, если электронная пара передается в общее пользование одним атомом (донором) другому атому (акцептору).
1. Обменный механизм Н. +. С1::: = Н: С1:::
При обменном механизме электронная пара, образующая связь, может образоваться как за счет неспаренных электронов, имеющихся в невозбужденном атоме, так и за счет распаренных электронов, образующихся при возбуждении атома. Например, в невозбужденном состоянии атом углерода имеет два неспаренных электрона, однако для него характерны соединения, в которых он образует четыре ковалентные связи. Это оказывается возможным в результате возбуждения атома. При этом один из s - электронов переходит на p - подуровень:
Увеличение числа создаваемых ковалентных связей сопровождается выделением большего количества энергии, чем затрачивается на возбуждение атома. Так как валентность атома зависит от числа неспаренных электронов, возбуждение атома приводит к повышению его валентности. Элементы 3-го периода пятой, шестой и седьмой групп (фосфор, сера и хлор) могут проявлять валентность, равную номеру группы. Это достигается возбуждением атомов с переходом 3 s - и 3 p -электронов на вакантные орбитали 3 d -подуровня. На примере атома хлора легко показать, что валентность может быть переменной:
Ковалентная связь может быть полярной и неполярной. Неполярная связь образуется, когда молекула составлена из атомов одинаковой природы с равными ЭО, например, Н2, F2, С12 и О2. (так называемая гомополярная связь). В этом случае, общая пара электронов располагается симметрично относительно взаимодействующих атомов. Рассмотрим это на примере образования молекулы фтора.
Таким образом, число возможных связей у атомов зависит не только от количества неспаренных электронов у атомов, но и от числа вакантных орбиталей одного атома и количества неподеленных электронных пар у другого атома соответственно. Обобществление одной пары электронов является частным случаем ковалентной связи. Во многих молекулах атомы приобретают полный октет электронов, обобществляя больше одной пары электронов, например: Н2С = СН2; НС≡СН; N≡N; О = С = О. Число связей, образующихся между атомами, называется кратностью, или порядком связи. Для примера рассмотрим образование типы и кратность связей в молекуле СО.
О
2 s 2 p Электронная структура валентных электронов атома углерода в нормальном состоянии 2 s 22 p 2. Невозбужденный атом углерода имеет два неспаренных p - электрона, которые могут образовать две общие электронные пары (2 связи) с двумя неспаренными электронами атома кислорода (электронная конфигурация 2 s 22 p 4 ) по обменному механизму. Однако имеющиеся в атоме кислорода два спаренных р - электрона могут образовать и третью химическую связь, поскольку в атоме углерода имеется одна незаполненная р - орбиталь, которая может принять эту пару. Таким образом, дополнительно образуется третья связь по донорно-акцепторному механизму: Кратность связи в молекуле СО равна трем. НАСЫЩАЕМОСТЬ И НАПРАВЛЕННОСТЬ КОВАЛЕНТНОЙ СВЯЗИ. Насыщаемость ковалентной связи обусловлена ограниченными валентными возможностями атомов, т.е. их способностью к образованию строго определенного числа связей, которое обычно лежит в пределах от 1 до 6. Общее число валентных орбиталей в атоме, т.е. тех, которые могут быть использованы для образования химических связей, определяет максимально возможную ковалентность элемента в данном соединении. Направленность ковалентной связи является результатом стремления атомов к образованию наиболее прочной связи за счет возможно большей электронной плотности между ядрами. Это достигается при такой пространственной направленности перекрывания атомных орбиталей, которая совпадает с линией, соединяющей взаимодействующие атомы (см., например, рис.2Б). Исключение составляют s - электронные АО, сферическая форма которых делает все направления равноценными. Таким образом, образование ковалентной связи является результатом перекрывания валентных атомных орбиталей АО, которые характеризуются определенными ориентациями в пространстве, и поэтому ковалентная связь имеет строго определенную направленность. Направление ковалентных связей характеризуется валентными углами – углами между линиями, соединяющими связываемые атомы в молекуле. Совокупность длин связей и валентных углов определяет пространственное равновесное строение молекулы, в которой имеет место равенство сил притяжения и отталкивания и которое обеспечивает минимальное значение ее энергии. Между двумя атомами в химическом соединении возможна только одна σ - связь. Совокупность направленных, строго ориентированных в пространстве σ - связей создает пространственную структуру молекулы вещества.
Для р - и d – электронных облаков перекрывание может осуществляться как вдоль оси, по которой они вытянуты, так и в параллельном направлении В первом случае образующаяся связь называется σ-связью (см. схему и рис.3). После образования между двумя атомами σ-связи для остальных электронных облаков той же формы и с тем же главным квантовым числом остается только возможность бокового перекрывания по обе стороны от линии связи. В результате образуется π - связь. Она менее прочна, чем σ-связь: перекрывание происходит диффузионными боковыми частями орбиталей. Каждая кратная связь (например, двойная или тройная) всегда содержит только одну σ-связь.
Рис. 3. Схемы образования σ-связей с участием электронных АО различных типов
Рис. 4. Схемы образования π-связей с участием электронных АО различных типов
Таким образом, химическая связь характеризуется энергией, длиной, направленностью, кратностью, насыщаемостью и полярностью. Для молекул, состоящей более чем из двух атомов, существенными являются величины углов между связями и полярность молекулы в целом. Валентность – это способность атома к образованию химических связей. Согласно обменному механизму, валентность элементов определяется числом содержащихся в атоме одноэлектронных атомных орбиталей. Для s -, p - элементов – это электроны внешнего уровня, для d - элементов – внешнего (s) и предвнешнего (d) подуровня.
ГИБРИДИЗАЦИЯ И ПРОСТРАНСТВЕННАЯ КОНФИГУРАЦИЯ МОЛЕКУЛ. В нормальном состоянии атом углерода имеет следующую электронную структуру:
2 s 2 p Казалось бы, что за счет имеющихся двух неспаренных электронов углерод может образовать две ковалентные связи (одну σ- и однуπ-связь). Между тем для углерода более характерны соединения, в которых каждый его атом связан с соседними четырьмя ковалентными связями (СО2, СН4, С2Н6 и т.д.). Это оказывается возможным благодаря тому, что при затрате небольшого количества энергии один из имеющихся спаренных s -электронов можно перевести на подуровень 2 р, в результате чего атом переходит в возбужденное состояние. В этом случае число одноэлектронных атомных орбиталей возрастает до 4-х и наблюдается вырождение (выравнивание энергий) самих АО
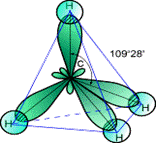
2 s 2 p Теперь во внешнем электронном слое углерода находятся четыре одноэлектронных атомных орбитали, которые могут участвовать в образовании четырех ковалентных связей. Процесс смешивания и вырождения АО называется гибридизацией, для него характерно образование «равноценных» или вырожденных орбиталей, которые имеют отличную от s - и р - орбиталей форму и усредненную энергию. В целом процесс гибридизации включает следующие этапы: возбуждение атома, гибридизация орбиталей возбужденного атома и образование связей с другими атомами. Затраты энергии на первые два этапа компенсируются выигрышем энергии при образовании более прочных связей с гибридными орбиталями. Таким образом, гибридизация– это изменение энергии и формы атомных орбиталей одного или нескольких энергетических уровней, обеспечивающих достижение более эффективного перекрывания орбиталей. В результате, обеспечивается максимальная перекрываемость АО, минимум энергии молекулы и достигается большая прочность связей между атомами. sp 3-Гибридизация. В случае углерода и образования четырех σ-связей имеем так называемую sp 3-гибридизацию (1 - s и 3 - р электрона). Одна s -орбиталь и три p -орбитали превращаются в четыре одинаковые «гибридные» sp 3-орбитали, угол между осями которых равен 109°28':
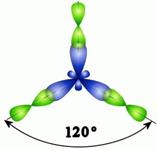
CH4 С2Н6 Молекулы, в которых осуществляется sp 3-гибридизация, имеют тетраэдрическую геометрию (CH4, CС14, С2Н6). sp 2 -Гибридизация. Данный вид гибридизации характерен для атомов IIIА группы, например, В и А1 (ns 2 nр 1). Три sp 2-орбитали могут образовывать три σ-связи (BF3, AlCl3). Примером молекулы, в которой осуществляется этот вид гибридизации, может служить молекула фторида бора ВF3:
2 s 2 p
Схема возникновения гибридных орбиталей в этом случае выглядит следующим образом.Одна s -орбиталь и две p -орбитали превращаются в три одинаковые «гибридные» орбитали, угол между осями которых равен 120°: Молекулы, в которых осуществляется sp 2-гибридизация, имеют плоскую геометрию. Ниже приведены модели и геометрия молекул ВН3 и ВС13:
ВН3 ВС13 sp -Гибридизация. sр - гибридизация характерна для IIА группы периодической системы элементов Ве, Мg, Ca, Ba, Zn, Cd и Hg.
2 s 2 p Поэтому для участия в образовании химических связей по обменному механизму атом Ве должен перейти в возбужденное состояние:
В этом случае возбужденный атом Ве имеет два неспаренных электрона и может образовывать две связи с другими атомами. Одна s -орбиталь и одна p -орбиталь превращаются в две одинаковые «гибридные» орбитали, угол между осями которых равен 180°. Две sp -орбитали могут образовывать две s-связи (BeH2, ZnCl2). Молекула гидрида бериллия выглядит следующим образом:
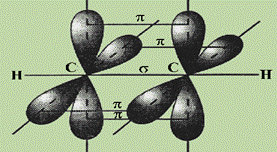
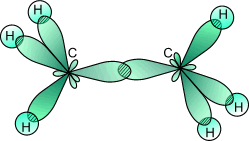
H Ве H Молекулы, в которых осуществляется sp -гибридизация, имеют линейную геометрию. Такой же вид гибридизации и такую конфигурацию имеют молекулы MgС12, CaС12 и SrС12. Следует иметь в виду, что гибридизация осуществляется только по σ- связям, а π - связи участия в гибридизации не принимают. Например, в этилене тип гибридизации для углерода не sp 3, а sp 2. Во всех ацетиленовых углеводородах, имеющих в молекуле одну тройную связь: C2H2, C4H6, C6H10 и других органических соединениях со связями -С ≡ С- наблюдается sp -гибридизация.. В ацетилене две гибридные орбитали атомов углерода образуют две σ-связи с соседним атомом углерода и атомом водорода, а две негибридные, сформированные за счет перекрывания pz - и pу - орбиталей углерода образуют две π-связи. Между С и Н всегда формируется σ - связь.
Рис. 5. Схема перекрывания АО в молекуле ацетилена
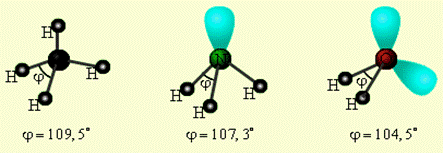
В некоторых случаях в гибридизации участвуют не образующие связь валентные электронные пары центрального атома, так называемые несвязывающие электронные пары. Пространственную конфигурацию молекулы или иона и тип гибридизации определяет суммарное число связывающих и несвязывающих электронных пар. Для объяснения строения молекул, их геометрической формы и типа гибридизации, используется теория так называемых локализованных электронных пар (метод Гиллеспи). ТЕОРИЯ ЛОКАЛИЗОВАННЫХ ЭЛЕКТРОННЫХ ПАР (МЕТОД ГИЛЛЕСПИ). В основе метода Гиллеспи лежит модель отталкивания локализованных электронных пар. Предполагается, что каждая пара электронов, окружающая атом, обозначаемая в формулах двумя точками, образуют электронные облака, которые вследствие отталкивания располагаются на друг от друга как можно дальше.. Реальная геометрия молекулы определяется не только числом σ – связей, но и количеством неподеленных электронных пар (Е). Тогда молекула метана соответствует формуле CH4, аммиака – NH3E, воды – H2OE2 и при этом будет наблюдаться одинаковая гибридизация (рис.5). У азота на sp3-гибридных орбиталях, помимо трех связывающих пар электронов, образующих связь с тремя атомами водорода, остается одна несвязывающая (неподеленная) электронная пара. Именно она, занимая четвертую sp3- гибридную орбиталь, искажает угол связи H–N–H до 107,3° (в метане, например, где неподеленных электронных пар нет, угол равен 109,5о). В молекуле H2O таких несвязывающих неподеленных пар две, и угол H–O–H равен не 90о (если бы не было гибридизации), а 104,5о (рис. 5).
CH4 : NH3 H2O:: Рис. 5. Несвязывающие электронные пары и углы связи в NH3, H2O и CH4
Для трехатомной молекулы AX2, не имеющей неподеленные электронные пары, возможно единственное строение – линейное; четырехатомная молекула AX3 будет плоской в форме равностороннего треугольника; пятиатомная AX4 – тетраэдрической; шестиатомная AX5 будет иметь форму тригональной бипирамиды, а семиатомная AX6 – форму октаэдра. Иное дело – наличие в молекуле неподеленных электронных пар. В этом случае геометрия молекулы существенно меняется. Молекула AX2E будет уже не линейной, а угловой, AX3E будет иметь форму треугольной пирамиды, а AX2E2 вновь будет угловой, причем угол будет существенно меньше тетраэдрического (например, H2O). В молекуле AX4E возможная структура – треугольнопирамидальная. Молекула AX5E имеет структуру квадратной пирамиды, а молекула AX4E2 – октаэдра (см. табл.1).
Таблица 1
|


 2. Донорно-акцепторный механизм А +:В = А: В Здесь - свободная орбиталь атома А.
2. Донорно-акцепторный механизм А +:В = А: В Здесь - свободная орбиталь атома А.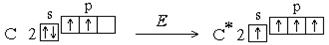


 F ns 2 np 5 F F
F ns 2 np 5 F F






 F
F 
 ДОНОРНО – АКЦЕПТОРНЫЙ МЕХАНИЗМ СВЯЗИ. Ковалентные связи могут образовываться и за счет спаренных электронов, имеющихся на внешнем электронном слое одного из атомов. В этом случае второй атом должен иметь на внешнем слое свободную орбиталь. Например, образование иона аммония из молекулы аммиака и иона водорода можно отобразить представленной схемой. Изображение электронов крестиками и точками на схеме весьма условно, так как в действительности электроны неразличимы. При образовании положительно заряженного катиона аммония, входящий в состав молекулы аммиака азот поставляет пару электронов и является донором, а ион Н+, имеющий свободную АО и принимающий электроны, является акцептором. Донорно-акцепторная связь по своим свойствам ничем не отличается от обычной ковалентной связи, образованной по обменному механизму.
ДОНОРНО – АКЦЕПТОРНЫЙ МЕХАНИЗМ СВЯЗИ. Ковалентные связи могут образовываться и за счет спаренных электронов, имеющихся на внешнем электронном слое одного из атомов. В этом случае второй атом должен иметь на внешнем слое свободную орбиталь. Например, образование иона аммония из молекулы аммиака и иона водорода можно отобразить представленной схемой. Изображение электронов крестиками и точками на схеме весьма условно, так как в действительности электроны неразличимы. При образовании положительно заряженного катиона аммония, входящий в состав молекулы аммиака азот поставляет пару электронов и является донором, а ион Н+, имеющий свободную АО и принимающий электроны, является акцептором. Донорно-акцепторная связь по своим свойствам ничем не отличается от обычной ковалентной связи, образованной по обменному механизму.



 С
С




 :С ≡ О:
:С ≡ О: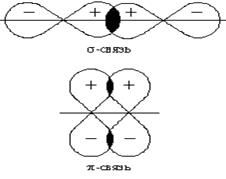



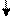


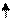

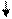









 В*
В*